Теория:
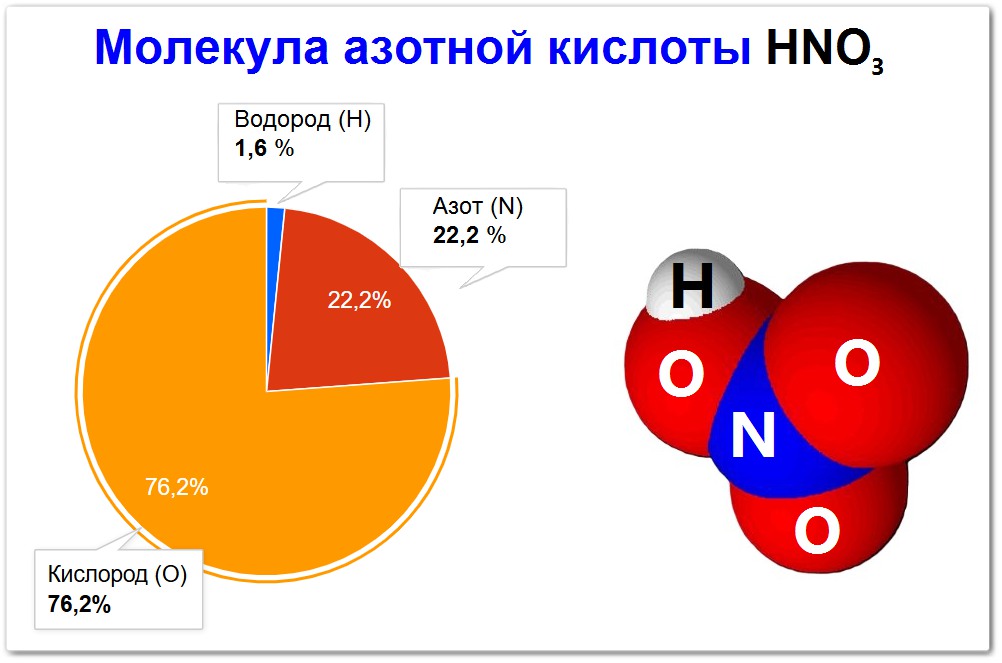
Молекула азотной кислоты — это химическое соединение с формулой HNO3.
Простыми словами, это очень важная и сильная кислота, которая состоит из:
- одного атома Водорода (H)
- одного атома Азота (N)
- трех атомов Кислорода (O)
Эти атомы соединены между собой химическими связями, образуя стабильную, но очень реакционноспособную молекулу.
Основные характеристики и свойства молекулы
Молекула азотной кислоты имеет химическую формулу HNO3.
Состав:
Одна молекула HNO3 состоит из:
- Одного атома водорода (H).
- Одного атома азота (N).
- Трех атомов кислорода (O).
Структура (Геометрия)
- Молекула азотной кислоты имеет плоскую (планарную) структуру.
- Атом азота находится в центре, и к нему присоединены три атома кислорода.
- Один атом кислорода связан с азотом двойной связью (N=O).
- Один атом кислорода связан с азотом одинарной связью и также связан с атомом водорода (N-O-H).
- Третий атом кислорода связан с азотом одинарной связью, но также участвует в резонансе, что означает, что его связь с азотом имеет промежуточный характер между одинарной и двойной. Заряд на азоте при этом +1, а на одном из кислородов -1.
- Молекула является полярной из-за неравномерного распределения электронной плотности.
Молекулярная масса
- Атомная масса водорода (H) ≈ 1.008 а.е.м.
- Атомная масса азота (N) ≈ 14.007 а.е.м.
- Атомная масса кислорода (O) ≈ 15.999 а.е.м.
- Молекулярная масса HNO3 = 1.008 + 14.007 + (3 × 15.999) = 1.008 + 14.007 + 47.997 = 63.012 а.е.м.
- Молярная масса HNO3 ≈ 63.01 г/моль.
Физические свойства (чистой азотной кислоты)
- Агрегатное состояние: Жидкость.
- Цвет: В чистом виде бесцветная, но часто приобретает желтоватый или коричневатый оттенок из-за разложения с образованием оксидов азота (например, NO2).
- Запах: Едкий, удушливый.
- Плотность: Около 1.51 г/см3 при 20 °C.
- Температура кипения: ≈ 83 °C.Температура плавления: ≈ -42 °C.
- Растворимость в воде: Полностью смешивается с водой в любых пропорциях.
Химические свойства
- Сильная кислота: В водном растворе полностью диссоциирует, отдавая протон (H+) и образуя нитрат-ион (NO3—).
- Сильный окислитель: Является очень сильным окислителем, особенно в концентрированном виде, и может реагировать со многими металлами и неметаллами, часто без выделения водорода, а с образованием различных оксидов азота.
- Нитрация: Используется для введения нитрогруппы (-NO2) в органические соединения, что важно для производства взрывчатых веществ (например, нитроглицерина, тротила) и красителей.
Применение
- Производство удобрений (главным образом аммиачной селитры).
- Производство взрывчатых веществ.
- Органический синтез.
- Травление металлов и очистка поверхностей.
- Лабораторный реагент.
Пример решения, задача:
Какова масса 0.5 моль азотной кислоты (HNO3)?
Решение:
Масса (m) = Количество вещества (n) × Молярная масса (M)
m(HNO₃) = 0.5 моль × 63.02 г/моль = 31.51 г.
Ответ: 31.51 г.
Часто задаваемые вопросы
Какова химическая формула молекулы азотной кислоты?
Записывается HNO3, произноситься: (аш-эн-о-три).
Какая связь в молекуле азотной кислоты?
Тип химической связи — ковалентная полярная.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.