Теория:
Молекула сероводорода — это неорганическое химическое соединение серы и водорода с формулой H2S.
Имеет угловую (изогнутую) структуру.
Центральный атом — сера (S), к которой присоединены два атома водорода (H).
Угол связи H-S-H составляет примерно 92,1°.
Атом серы находится в sp3 -гибридизации, и угловая форма обусловлена наличием двух неподеленных электронных пар на атоме серы, которые отталкивают связывающие пары.
Молекула является полярной.
Молекулярная масса сероводорода: 34.09 г/моль.

Основные характеристики и свойства молекулы
Молекула сероводорода (H2S) обладает рядом характерных свойств и характеристик, которые делают её важной:
Основные характеристики и свойства молекулы сероводорода:
✅ Химическая формула и состав:
H2S (один атом серы, два атома водорода).
Является бинарным неорганическим соединением.
✅ Агрегатное состояние и запах:
При нормальных условиях (комнатная температура, атмосферное давление) это бесцветный газ.
Имеет очень резкий, характерный и крайне неприятный запах тухлых яиц.
✅ Токсичность:
Чрезвычайно ядовит даже в низких концентрациях.
Может быстро вызывать паралич обонятельных нервов, из-за чего человек перестает ощущать его запах, что делает его крайне опасным и коварным.
Высокие концентрации смертельны.
✅ Растворимость:
Плохо растворим в воде. Его водный раствор известен как сероводородная вода (или сероводородная кислота).
Хорошо растворим в некоторых органических растворителях, например, в этаноле.
✅ Горючесть и химическая реактивность:
Горюч: Легко воспламеняется на воздухе, сгорая до сернистого газа (SO2) и воды.
2H2S + 3O2 → 2SO2 + 2H2O
✅ Слабая кислота: В водном растворе проявляет свойства слабой двухосновной кислоты (сероводородной кислоты), диссоциируя по двум ступеням:
H2S ⇄ H+ + HS—
HS— ⇄ H+ + S2-
✅ Восстановитель: Сера в H2S находится в низкой степени окисления (-2), поэтому сероводород является сильным восстановителем, особенно в щелочной среде.
Он легко окисляется до серы, сернистого газа или сульфатов.
Интересный факт: Карл Вильгельм Шееле (Carl Wilhelm Scheele), шведский химик, считается первым, кто идентифицировал химический состав очищенного сероводорода в 1777 году.
Структура (Геометрия)
Молекулярная геометрия:
Молекула H2S имеет угловую (изогнутую) форму, аналогично молекуле воды (H2O).
Атом серы находится в центре, а два атома водорода связаны с ним. Угол связи H-S-H составляет примерно 92,1°.
Центральный атом серы находится в sp3-гибридизации, но из-за наличия двух неподеленных электронных пар, которые отталкивают связывающие пары, молекула имеет угловую, а не тетраэдрическую геометрию.
Полярность:
Молекула полярна из-за своего углового строения и разницы в электроотрицательности между серой и водородом.
Полярность выражена слабее, чем у воды, поскольку сера менее электроотрицательна, чем кислород.
И водородные связи между молекулами H2S значительно слабее или практически отсутствуют, в отличие от сильных водородных связей в воде.
Это объясняет, почему H2S — газ, а H2O — жидкость при комнатной температуре.
Молекула сероводорода (H2S) имеет угловую (изогнутую) геометрическую структуру, очень похожую на структуру молекулы воды (H2O).
Вот основные моменты, касающиеся её геометрии:
Центральный атом: Атом серы (S) является центральным атомом.
Электронная геометрия: Если рассматривать все электронные пары вокруг центрального атома серы (как связывающие, так и неподеленные), то их четыре: две связывающие пары (с водородом) и две неподеленные пары электронов на атоме серы.
Эти четыре электронные пары располагаются в пространстве максимально далеко друг от друга, что соответствует тетраэдрической электронной геометрии.
Молекулярная геометрия: Однако, когда мы говорим о молекулярной геометрии, мы учитываем только расположение атомов, игнорируя неподеленные электронные пары в названии формы.
Поскольку на сере есть две неподеленные электронные пары, они «отталкивают» связывающие электронные пары к водородам, уменьшая угол между связями.
В результате молекула принимает угловую (или изогнутую) форму.
Угол связи: Угол между связями H-S-H составляет приблизительно 92,1°.
Это значение меньше идеального тетраэдрического угла 109,5°, что объясняется более сильным отталкиванием неподеленных электронных пар по сравнению со связывающими парами.
Гибридизация: Атом серы в молекуле H2S находится в sp3 -гибридизации.
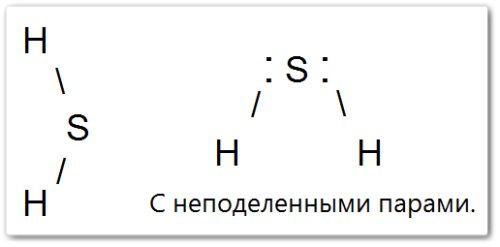
Эта угловая геометрия и разница в электроотрицательности между серой и водородом делают молекулу H2S полярной.
Физические свойства
Сероводород H2S — это газ с очень специфическими и важными физическими свойствами:
Агрегатное состояние и цвет: При нормальных условиях (комнатная температура и атмосферное давление) это (бесцветный газ.
Запах: Обладает резким, характерным и крайне неприятным запахом (тухлых яиц).
Этот запах ощущается даже при очень низких концентрациях, но в высоких концентрациях обоняние быстро притупляется, что делает его крайне опасным.
Вкус: Имеет сладковатый привкус, однако пробовать его крайне опасно из-за его токсичности.
Плотность: Сероводород тяжелее воздуха. Его относительная плотность по воздуху составляет примерно 1,19.
Плотность газа при 0 °C и 760 мм рт. ст. составляет около 1,5392 кг/м3. Это означает, что он может скапливаться в низменностях и плохо вентилируемых помещениях.
Температура плавления: -82,9 °C (или -85,7 °C, или -86 °C в различных источниках, что указывает на очень низкую температуру).
Температура кипения: -60,33 °C (или -60,2$ °C, или -60$ °C). Это относительно высокая температура кипения для соединения с такой небольшой молекулярной массой (34,08 г/моль), что отчасти объясняется его полярностью.
Растворимость:
В воде: малорастворим в воде. При 20 °C растворимость составляет около 0,5 г на 100 мл воды.
Его водный раствор образует слабую сероводородную кислоту. Растворимость уменьшается с повышением температуры и увеличивается с повышением давления.
В органических растворителях: Хорошо растворим в этаноле и других органических растворителях.
Горючесть: Сероводород является легковоспламеняющимся газом.
- Горит на воздухе синим пламенем, образуя сернистый газ SO2 и воду.
- Температура воспламенения (самовоспламенения) составляет около 260 — 270 °C.
- Пределы взрываемости в смеси с воздухом составляют 4,3 — 46% по объему.
Сжижение: Легко сжижается под давлением, образуя бесцветную жидкость. Это позволяет транспортировать его в баллонах в жидком виде.
Коррозионные свойства: Сероводород коррозионно активен, особенно во влажной среде, так как образует слабую кислоту. Он может разрушать многие металлы и некоторые пластики.
Число ковалентных связей в молекуле
В молекуле сероводорода (H2S) содержится 2 ковалентные связи.
Обе эти связи являются одинарными ковалентными связями S — H.
Пример решения, задача:
Расчет относительной молекулярной массы.
Дано: Молекула сероводорода (H2S).
Относительные атомные массы: Ar(H) ≈ 1,008;
Ar (S) ≈ 32,06.
Решение: Относительная молекулярная масса (Mr) равна сумме относительных атомных масс всех атомов в молекуле.
Mr(H2S) = (2 × Ar(H)) + Ar(S)
Mr(H2S) = (2 × 1,008) + 32,06
Mr(H2S) = 2,016 + 32,06
Mr(H2S) = 34,076
Ответ: Относительная молекулярная масса сероводорода составляет 34,076.
Часто задаваемые вопросы
Состоит из одного атома серы (S) и двух атомов водорода (H). Её химическая формула — H2S, бинарное химическое соединение.
Имеет ковалентные полярные связи. Потому, что:
Ковалентная связь: Сера и водород — это неметаллы. Химические связи между неметаллами образуются путём обобществления электронов, что характерно для ковалентной связи.
Полярная связь: Полярность связи определяется разностью электроотрицательностей атомов.
Причины кроются в размере центрального атома и длине связей:
Размер центрального атома:
В молекуле воды центральным атомом является кислород (O).
В молекуле сероводорода центральным атомом является сера (S).
Сера находится в 3-м периоде Периодической таблицы, тогда как кислород находится во 2-м периоде.
Атомы становятся больше по мере увеличения номера периода (движения вниз по группе), поскольку у них появляется дополнительный электронный слой.
Атом серы значительно крупнее атома кислорода. (Ковалентный радиус S ≈ 104 пм, ковалентный радиус O ≈ 74 пм).
Длина связей:
Из-за большего размера атома серы, связи S-H длиннее, чем связи O-H в молекуле воды.
Длина связи S-H составляет примерно 0,1336 нм (133,6 пм).
Длина связи O-H составляет примерно 0,096 нм (96 пм).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.