Теория:
Молекула воды — это химическое соединение с формулой H2O, чистое вещество, так как содержит одни молекулы воды.
Она состоит из:
Одного атома кислорода (O).
Двух атомов водорода (H).
Это ключевая молекула для жизни на Земле, известная своей изогнутой (V-образной) формой и полярностью.
Что позволяет ей образовывать водородные связи и обуславливает её свойства (например, способность быть отличным растворителем, высокие температуры кипения и плавления).
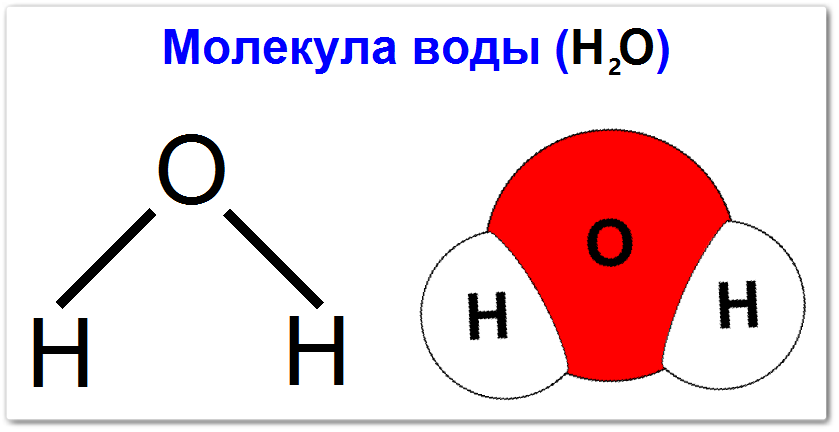
Что такое молекула воды (H2O)
Каждая молекула воды состоит из двух атомов водорода (H) и одного атома кислорода (O).
Поэтому её формула H2O, где «H» символизирует водород, «O» — кислород, а цифра «2» указывает на два атома водорода.
Атомы водорода и кислорода соединены между собой ковалентными связями.
Это означает, что они делятся электронами, чтобы достичь стабильности.
Вода является химическим соединением, поскольку она образована атомами более чем одного химического элемента — кислорода (O) и водорода (H).
Эти элементы химически соединены между собой в фиксированном соотношении (два атома водорода на один атом кислорода).
Ковалентные полярные связи
Атом кислорода и атомы водорода связаны между собой ковалентными связями, то есть они обобществляют электроны.
Кислород значительно более электроотрицателен, чем водород. Это означает, что кислород сильнее притягивает общие электроны к себе.
В результате, на атоме кислорода возникает частичный отрицательный заряд (δ−), а на каждом атоме водорода — частичный положительный заряд (δ+).
Угловая (изогнутая) геометрия
Атом кислорода в молекуле воды имеет две пары связующих электронов (с водородами) и две неподеленные электронные пары.
Эти четыре электронные пары (две связующие и две неподеленные) отталкиваются друг от друга и стремятся расположиться в пространстве таким образом, чтобы минимизировать отталкивание.
Это приводит к тетраэдрическому расположению электронных пар, но поскольку две из них — неподеленные, молекула воды принимает угловую (V — образную или изогнутую) форму.
Угол между связями H — O — H составляет примерно 104.5°, что немного меньше идеального тетраэдрического угла 109.5° из-за более сильного отталкивания неподеленных электронных пар.
Химические связи
Атомы кислорода и водорода соединены ковалентными связями. Это означает, что они обобществляют электроны для достижения стабильной электронной конфигурации.
Эти связи являются полярными ковалентными связями.
Кислород гораздо более электроотрицателен, чем водород. Это значит, что атом кислорода сильнее «тянет» к себе общие электроны в каждой связи O — H, чем водород.
В результате на атоме кислорода возникает частичный отрицательный заряд (δ−), а на каждом атоме водорода — частичный положительный заряд (δ+).
Интересный факт: точный химический состав молекулы воды, в первые определили два ученых, Генри Кавендиш английский ученый, в 1781 году.
И Антуан Лавуазье французский химик, в 1783 году.
Электронное строение кислорода и геометрия
Атом кислорода имеет 6 валентных электронов. Для достижения стабильного октета ему нужно 2 электрона, которые он получает от двух атомов водорода.
После образования двух связей O-H, у атома кислорода остаются две неподеленные электронные пары.
Эти две неподеленные электронные пары и две связующие пары (с водородами) отталкиваются друг от друга, стремясь занять макс
мально удаленные положения в пространстве.
В результате, несмотря на то что атом кислорода находится в состоянии sp3-гибридизации (что обычно приводит к тетраэдрической геометрии), наличие двух неподеленных пар «отталкивает» атомы водорода друг от друга.
Это приводит к «изогнутой» (угловой или V-образной) геометрии молекулы воды, а не линейной.
Угол между связями H — O — H составляет приблизительно 104.5° (немного меньше идеального тетраэдрического угла 109.5° из-за более сильного отталкивания неподеленных пар).
Полярность молекулы
Из-за полярности связей O — H и угловой геометрии молекула воды является полярной молекулой в целом.
Дипольные моменты отдельных связей не компенсируют друг друга, и у молекулы воды есть чётко выраженный положительный и отрицательный полюсы.
Из-за сочетания полярных связей и угловой геометрии, молекула воды в целом является полярной молекулой (диполем).
У неё есть чётко выраженный «положительный» полюс (со стороны атомов водорода) и «отрицательный» полюс (со стороны атома кислорода, где находятся неподеленные электронные пары).
Визуализация строения:
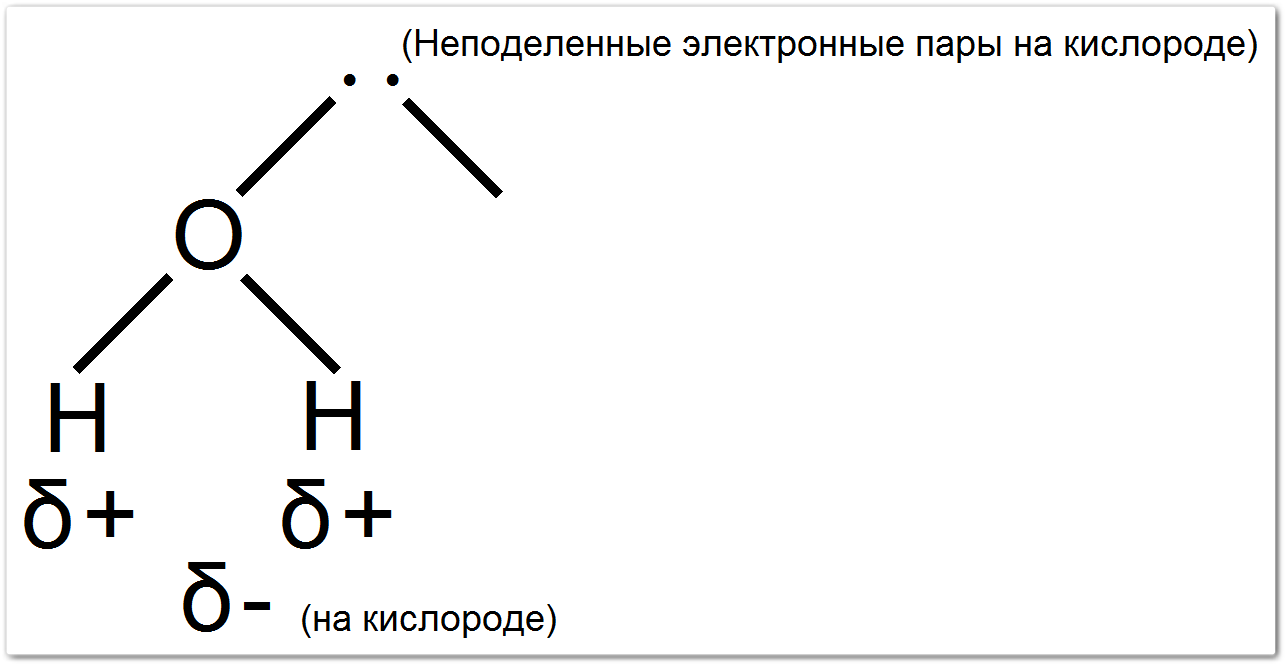
(На этой простой схеме точки обозначают неподеленные электронные пары, а и — частичные заряды.)
Наличие водородных связей
Полярность молекулы воды напрямую приводит к образованию водородных связей.
Частично положительный водород (δ+): В молекуле воды атомы водорода несут частичный положительный заряд (δ+), потому что кислород «оттягивает» от них электроны.
Частично отрицательный кислород (δ⁻): Атом кислорода в другой молекуле воды несёт частичный отрицательный заряд (δ—) и имеет две неподеленные электронные пары.
Притяжение: Положительно заряженный водород одной молекулы воды притягивается к отрицательно заряженному кислороду другой молекулы воды.
Это притяжение и есть водородная связь.
Сеть водородных связей
Каждая молекула воды может образовывать до четырёх водородных связей с соседними молекулами:
Два атома водорода в молекуле воды могут образовывать водородные связи с атомами кислорода двух соседних молекул.
Неподеленные электронные пары на атоме кислорода в молекуле воды могут образовывать водородные связи с атомами водорода двух других соседних молекул.
Последствия строения
Строение молекулы воды, особенно её полярность и наличие неподеленных электронных пар, позволяет ей образовывать водородные связи с другими молекулами воды и с другими полярными веществами.
Эти водородные связи являются причиной таких жизненно важных свойств воды, как:
- Высокие температуры кипения и плавления (для молекулы такого размера).
- Высокая удельная теплоемкость.
- Высокое поверхностное натяжение.
- Способность быть отличным растворителем для многих полярных веществ (вода — «универсальный растворитель»).
- Плотность льда ниже плотности жидкой воды.
Простая молекула H2O обладает очень сложным и функциональным строением, которое делает её незаменимой для жизни на Земле.
Пример решения, задача:
Определите сколько молекул воды содержится в капле объемом 50 мм 3 масса атома кислорода в 16 раз.
Дано: Объем капли воды (V) = 50 мм3.
Необходимые константы и значения:
Плотность воды (ρ) ≈ 1 г/см3 (при 4°C, но для обычных условий это хорошее приближение).
Атомная масса водорода (H) ≈ 1.008 г/моль.
Атомная масса кислорода (O) ≈ 15.999 г/моль.
Число Авогадро (NA) ≈ 6.022×1023 молекул/моль.
Расчеты:
Переведем объем из мм3 в см3:
1 см = 10 мм.
1 см3 = (10 мм)3 = 1000 мм3
V = 50 мм3 х (1 см3/1000 мм3) = 0.05 см3.
Найдем массу капли воды:
Масса (m) = Плотность (ρ) × Объем (V) m=1 г/см3 × 0.05 см3 = 0.05 г.
Рассчитаем молярную массу воды (H2O):
M(H2O) = (2 × M(H)) + M(O)
M(H2O) = (2 × 1.008 г/моль) + 15.999 г/моль.
M(H2O) = 2.016 г/моль + 15.999 г/моль = 18.015 г/моль.
Найдем количество моль воды в капле:
Количество моль (n) = Масса (m) / Молярная масса (M)
n = 0.05 г/18.015 г/моль ≈ 0.002775 моль.
Определим количество молекул воды:
Количество молекул = Количество моль (n) × Число Авогадро (NA)
Количество молекул = 0.002775 моль × 6.022 × 1023 молекул/моль.
Количество молекул 1.67 × 1021 молекул.
Ответ: В капле воды объемом 50 мм³ содержится приблизительно 1.67 × 1021 молекул воды.
Часто задаваемые вопросы:
Молекулы воды переходят от упорядоченного, ограниченного движения к быстрому, хаотичному движению с большими расстояниями между ними.
Вода (H2O) — это молекула, потому что она состоит из двух или более атомов, связанных между собой ковалентными связями.
В данном случае, два атома водорода соединены с одним атомом кислорода.
Масса одной молекулы воды равна 2,99·10-23 г.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.