Теория:
Молекулярная масса гидроксида меди (II) Cu(OH)2 это масса одной молекулы вещества, выраженная в атомных единицах массы (а.е.м.) или (г/моль).
Поэтому она рассчитывается как сумма атомных масс входящих в ее состав элементов.
Молекулярную массу каждого химического элемента можно найти в таблице химических элементов Менделеева.
Единицы расчета для определения: атомная единица массы (а.е.м.) и грамм на моль (г/моль).
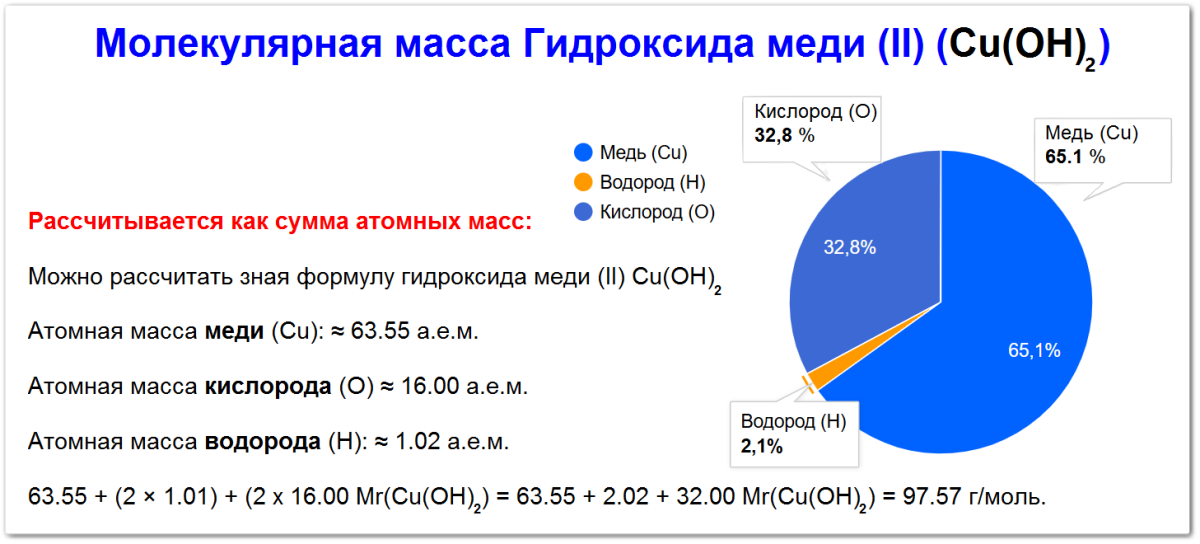
Как вычислить молекулярную массу гидроксида меди
Cu(OH)2
Молекулярная масса гидроксида меди Cu(OH)2 рассчитывается как сумма атомных масс входящих в его состав элементов:
Медь (Cu): ≈ 63.55 а.е.м..
Кислород (O): ≈ 16.00 а.е.м.
Водород (H): ≈ 1.01 а.е.м.
Формула гидроксида меди (II) — Cu(OH)2. Это означает, что в одной молекуле содержится 1 атом меди, 2 атома кислорода и 2 атома водорода (поскольку группа OH повторяется дважды).
Расчет молекулярной массы Cu(OH)2:
Mr(Cu(OH)2) = Ar(Cu) + 2 × (Ar(O) + Ar(H)) Mr(Cu(OH)2) = 63.55 + 2 × (16.00 + 1.01) Mr(Cu(OH)2) = 63.55 + 2 × (17.01) Mr(Cu(OH)2) = 63.55 + 34.02 Mr(Cu(OH)2) = 97.57 а.е.м.
Молекулярная масса гидроксида медим (II) Cu(OH)2 составляет приблизительно 97.57 атомных единиц массы (а.е.м.), или 97.57 г/моль.
Если вам нужна молярная масса, она численно равна этому значению, но выражается в граммах на моль (г/моль):
Молярная масса Cu(OH)2 ≈ 97.57 г/моль.
Процентное содержание элементов в гидроксиде меди (II) Cu(OH)2
Для этого нам понадобятся:
- Молекулярная масса Cu(OH)2.
- Относительные атомные массы каждого элемента (Cu, O, H).
Относительные атомные массы (округляем до двух знаков после запятой для удобства):
- Медь (Cu): ≈ 63.55
- Кислород (O): ≈ 16.00
- Водород (H): ≈ 1.01
Шаг 1: Рассчитаем молекулярную массу Cu(OH)2
В одной молекуле Cu(OH)2 содержится:
- 1 атом меди (Cu)
- 2 атома кислорода (O) (поскольку группа OH повторяется дважды)
- 2 атома водорода (H) (поскольку группа OH повторяется дважды)
Mr(Cu(OH)2) = Ar(Cu) + 2 × (Ar(O) + Ar(H)) Mr(Cu(OH)2) = 63.55 + 2 × (16.00 + 1.01) Mr(Cu(OH)2) = 63.55 + 2 × 17.01 Mr(Cu(OH)2) = 63.55 + 34.02 Mr(Cu(OH)2) = 97.57
Шаг 2: Рассчитаем процентное содержание каждого элемента.
Процентное содержание меди (Cu): Масса Cu в молекуле = 1 × 63.55 = 63.55 Процент Cu = (Масса Cu / Молекулярная масса Cu(OH)2) × 100% Процент Cu = (63.55 / 97.57) × 100% ≈ 65.13%
Процентное содержание кислорода (O): Масса O в молекуле = 2 × 16.00 = 32.00 Процент O = (Масса O / Молекулярная масса Cu(OH)2) × 100% Процент O = (32.00 / 97.57) × 100% ≈ 32.79%
Процентное содержание водорода (H): Масса H в молекуле = 2 × 1.01 = 2.02 Процент H = (Масса H / Молекулярная масса Cu(OH)2) × 100% Процент H = (2.02 / 97.57) × 100% ≈ 2.07%
Проверка (сумма должна быть около 100%): 65.13% + 32.79% + 2.07% = 99.99%
Процентное содержание элементов в гидроксиде меди (II) Cu(OH)2 составляет приблизительно:
- Медь (Cu): 65.13%
- Кислород (O): 32.79%
- Водород (H): 2.07%
Пример решения, задача:
Задача № 1.
Какова масса 0.2 моль гидроксида меди (II) Cu(OH)2?
Решение: Масса (m) = Количество вещества (n) × Молярная масса (M) m(Cu(OH)2) = 0.2 моль × 97.57 г/моль = 19.514 г.
Задача № 2.
Сколько моль гидроксида меди(II) Cu(OH)2 содержится в 48.785 г этого соединения?
Решение: Количество вещества (n) = Масса (m) / Молярная масса (M) n(Cu(OH)2) = 48.785 г / 97.57 г/моль = 0.5 моль.
Часто задаваемые вопросы
Относительная молекулярная масса Cu(OH)2 рассчитывается сумма атомных масс веществ.
Причем нужно всегда учитывать количество атомов, так этом случае один атом меди, два атома кислорода и два атома водорода.
63.55 + 2 × (16.00 + 1.01) = 97.57 а.е.м. или 97.57 г/моль.
Молярная масса нитрата кальция Cu(OH)2 составляет 97.57 г/моль.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.