Теория:
Молекулярная масса нитрата кальция Ca(NO3)2 это масса одной молекулы вещества, выраженная в атомных единицах массы (а.е.м.).
Поэтому она рассчитывается как сумма атомных масс входящих в ее состав элементов.
Молекулярную массу каждого химического элемента можно найти в таблице химических элементов Менделеева.
Как вычислить молекулярную массу нитрата кальция
Молекулярная масса карбоната кальция рассчитывается как сумма атомных масс входящих в его состав элементов:
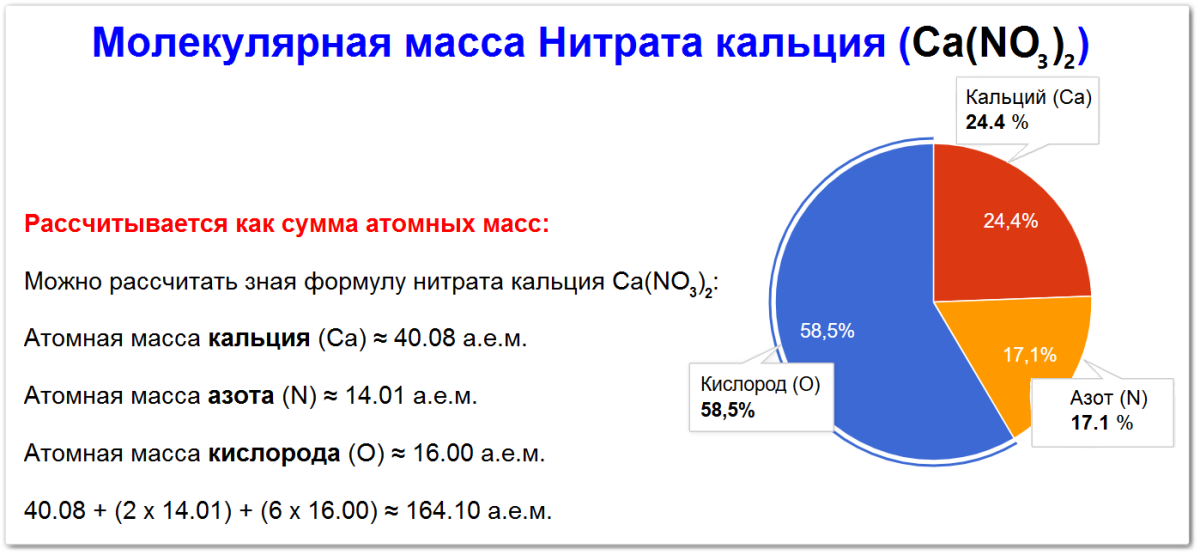
Атомная масса кальция (Са) ≈ 40.08 а.е.м.
Атомная масса азота (N) ≈ 14.01 а.е.м.
Атомная масса кислорода (О) ≈ 16.00 а.е.м.
Поэтому молекулярная масса составляет:
Mr(Ca(NO3)2) = Ar(Ca) + 2 x Ar(N) + 6 x Ar(O) = 40.08 + (2 x 14.01) + (6 х 16.00) ≈ 164.10 г/моль.
Молярная масса нитрата кальция которая численно равна молекулярной массе, составляет примерно 164.10 г/моль.
Часто используют округленные значения атомных масс (Са = 40.08, N = 28.02, О = 96.00), в этом случае молекулярная масса будет: г/моль.
При расчете всегда нужно учитывать нитрат кальция встречается в виде кристаллогидрата Ca(NO3)2 х 4Н2О.
То в этом случае молярная масса тетрагидрата нитрата натрия кальция будет приблизительно равна 236.15 г/моль.
Процентное содержание элементов в нитрате кальция
Процентное содержание элементов в нитрате кальция (Ca(NO3)2) рассчитывается на основе его молекулярной массы.
Молекулярная масса ≈ 164 а.е.м (если использовать более точные атомные массы: (Са ≈ 40.08, N ≈ 28.02, О ≈ 96.00).
Если использовать округленные значения (Са = 40, N ≈ 28, О ≈ 96 а.е.м.), то молекулярная масса будет ≈ 164 а.е.м.
Рассчитаем процентное содержание, используя округленные значения для простоты:
1. Масса кальция (Са):
- В молекуле Ca(NO3)2 содержится 1 атом Ca.
- Общая масса Ca = 40 а.е.м.
2. Масса азота (N):
- В молекуле Ca(NO3)2 содержится 2 атома N.
- Общая масса N = 14 х 2 = 28 а.е.м.
3. Масса кислорода (О):
- В молекуле Ca(NO3)2 содержится 6 атомов О.
- Масса О = 16 х 6 = 96 а.е.м.
3. Общая молекулярная масса (Ca(NO3)2):
40 а.е.м. + 28 а.е.м. + 96 а.е.м. = 164 а.е.м.
4. Процентное содержание Ca(NO3)2:
- (Масса кальция / Молекулярная масса (Ca(NO3)2) × 100% = (40 / 164) × 100% ≈ 24.3 %
5. Процентное содержание N:
- (Масса азота / Молекулярная масса (Ca(NO3)2) × 100% = (28 / 164) × 100% ≈ 17.1%
6. Процентное содержание О:
- (Масса кислорода / Молекулярная масса (Ca(NO3)2) × 100% = (96 / 164) × 100% ≈ 58.5%
Таким образом, в Ca(NO3)2 содержится примерно:
- 24.3 % кальция
- 17.1 % азота
- 58.5 % кислорода
Если использовать более точные атомные массы, процентные содержания будут немного отличаться.
Пример решения, задача:
Задача № 1.
Дано: Сколько моль нитрата кальция (Ca(NO3)2) содержится в образце массой 41 г? (Используйте молярную массу 164 г/моль).
Решение: Количество вещества (n) = Масса (m) / Молярная масса (M) n(Ca(NO3)2) = 41 г / 164 г/моль = 0,25 моль.
Ответ: 0,25 моль.
Задача № 2.
Дано: Какова масса 0,5 моль нитрата кальция (Ca(NO3)2)? Используйте молярную массу, рассчитанную в предыдущей задаче.
Решение: Масса (m) = Количество вещества (n) × Молярная масса (M)
m(Ca(NO3)2) = 0,5 моль × 164 г/моль = 82 г.
Ответ: 82 г.
Часто задаваемые вопросы
Молярная масса нитрата кальция Ca(NO3)2 составляет 164.09 г/моль.
Относительная молекулярная масса Ca(NO3)2 рассчитывается сумма атомных масс веществ.
Причем нужно всегда учитывать количество атомов, так этом случае один атом кальция Са, два атома азота N, шесть атомов кислорода О.
40.08 + (2 x 14.01) + (6 х 16.00) ≈ 164.10

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.