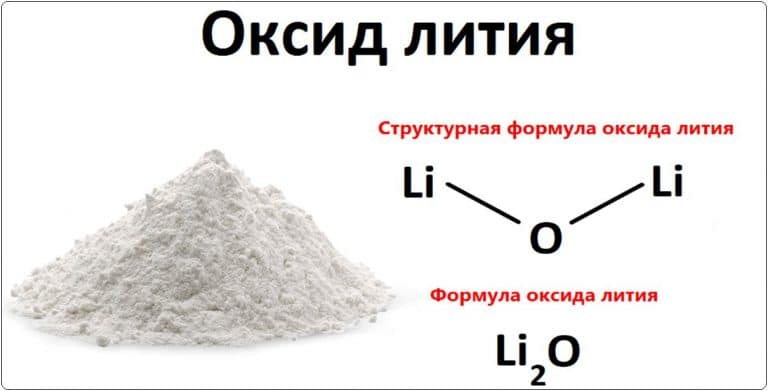
Что такое оксид лития
Оксид лития представляет собой белое твердое неорганическое соединение, которое образуется при разложении пероксида лития при температуре 200 — 300 ºС.
Кроме того, при сжигании металлического лития на воздухе, смешанном с кислородом, образуется оксид лития с небольшими следами перекиси лития.
Чистый оксид лития также образуется при разложении перекиси лития при 450 ºС.
Таким образом, химическая формула оксида лития равна Li2O.
Другая формула оксида лития широко известна как литий или кикерит. Это сильно нерастворимая, но термически стабильная форма лития.
Структурированные перовскитом оксиды обладают высокой электропроводностью по своей природе и поэтому широко используются в качестве катода твердооксидных топливных элементов и систем выработки кислорода.
Анализируя химическую формулу оксида лития (Li2О), ясно, что связь, разделяемая между двумя атомами лития и одним атомом кислорода, является ионной по своей природе.
Поскольку литий, являющийся металлом 1-й группы, обладает высокой электроположительностью, в то время как кислород, являющийся элементом 16-й группы, обладает высокой электроотрицательностью по своей природе.
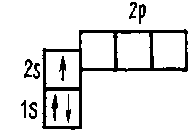
Таким образом, литий 1с[2]2с[1] имеет один валентный электрон в своей самой внешней оболочке, который легко доступен для пожертвования с образованием Li+1 ион.
И кислород может легко получить 2 электрона для увеличения своего октанового числа и образования O2− ион.
Таким образом, в Li2O, два иона лития отдают электроны своей внешней оболочки кислороду, который принимает два пожертвованных электрона для завершения максимальной подоболочки 2p.
Таким образом, ионная формула оксида лития будет равна:
2Li[+]O[2−].
Химическое название формулы
| Химическая формула | Li2О |
| Название | Оксид лития |
| IUPAC название | Дилития оксид |
Структура оксида лития
Из химической формулы оксида лития (Li2О) было замечено, что в твердом состоянии оксиды лития принимают антифлюоритовую структуру, которая аналогична структуре флюорита кальция.
Здесь, в структуре флюорита кальция, атомы фтора заменены атомами лития, а атом кальция заменен атомом кислорода.
Таким образом, химическая формула оксида лития демонстрирует четыре скоординированных иона лития. Li[+] в виде центров с восемью координированными оксидами вокруг центров.
В основном состоянии газовой фазы оксид лития демонстрирует линейную связь, которая устанавливается на основе сильной электростатической силы притяжения между атомами, которые являются ионными по своей природе.
Согласно теории VESPER, форма оксида лития изогнута, что аналогично форме молекулы воды.
С помощью обычного метода электрического отклонения было обнаружено, что оксид лития не полярен по своей природе, поэтому равновесный угол связи между атомами лития и кислорода составляет около 180º.
Согласно ионной формуле оксида лития, координатная геометрия литий-ионного:
Li[2+]
является тетраэдрическим , тогда как ион кислорода O[2−] имеет кубическую природу.
Структурное представление химической формулы оксида лития показано выше.
Альтернативное схематическое представление литий-кислородной формулы в виде модели шарика и палочки для их единичного элемента также проиллюстрировано ниже для более четкого понимания.
Физические свойства оксида лития
Оксид лития представляет собой твердое кристаллическое вещество белого цвета, а молярная масса оксида лития равна 29,88 г/моль. Его плотность измеряется как 2,013 г/см3.
Это сильное основание со значением рН 9,28, также известным как логарифмическое значение, хорошо растворимо в воде.
И всякий раз, когда оно вступает в контакт с водой при растворении, вступает в активную реакцию с образованием гидроксида лития LiOH.
У него очень высокая температура плавления и кипения. Таким образом, температура кипения оксида лития измеряется равной 2600 ºC, тогда как его температура плавления составляет около 1438 ºC.
Имеет антифлюоритовую структуру с тетраэдрической и кубической геометрией координат для ионов лития и кислорода соответственно.
Показатель преломления измеряется на уровне 1,644. Его теплоемкость составляет 1,8105 Дж/г К или 54,1 Дж/моль К.
Стандартная молярная энтропия и стандартная энтальпия образования измеряются как 37,88 Дж/моль К и -595,8 КДЖ/моль соответственно, при этом свободная энергия Гиббса равна -562,1 КДЖ/моль.
Получение
Оксид лития может быть получен взаимодействием лития с кислородом:
4Li + O2 → 2Li2O
или разложением пероксида лития при температуре 195 °C:
2Li + O2 → 2Li2O + О2↑
А также из его солей например термического разложения карбоната лития:
Li2CO3 → Li2O + CO2
Термическим разложением нитрата лития:
4LiNO3 → 2Li2O + 4NO2 + O2↑
Химические свойства
Оксид лития взаимодействуя с водой образует щелочь:
LiO2 + H2O → 2LiOH
Как и другие щелочные металлы реагирует с кислотами образуя при этом хлорид лития LiCl, нитрат лития LiNO3, и сульфат лития Li2SO4:
Li2O + 2HCl → 2LiCl + H2O,
Li2O + 2HNO3 → 2LiNO3 + H2O,
Li2O + 2H2SO4 → Li2SO4 + H2O
Применение оксида лития
Оксид лития в сочетании с медью придает синий цвет, а в смеси с кобальтом — розовый, и поэтому его широко используют для глазирования керамики.
Но поскольку оксид лития интенсивно реагирует с водой, следовательно, его необходимо хранить изолированным от воды.
В системе теплозащитных покрытий оксид лития используется для оценки результатов неразрушающей эмиссионной спектроскопии, а также для мониторинга деградации в системе.
Его также добавляют в качестве сопутствующей добавки с оксидом иттрия, который представляет собой твердое вещество белого цвета, устойчивое к воздействию воздуха, также известное как иттрий.
В качестве верхнего покрытия для керамики, поскольку он не так легко разрушается и поэтому считается верхним покрытием, которое сохраняется в течение более длительного периода времени.
При очень высокой температуре оксид лития выделяет очень определенный рисунок, который легко обнаруживается, и по мере увеличения его интенсивности покрытие из оксида лития уменьшается.
Но из-за его спектроскопической природы, его имплантация позволяет системе мониторинга на месте, что позволяет им точно прогнозировать срок службы, если только не произойдет какого-либо серьезного сбоя.
Он используется в качестве охлаждающей жидкости на многих атомных станциях и в качестве загустителя для придания пластичным смазкам определенной консистенции.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.