Химическая связь сила притяжения между атомами или ионами молекул возникает за счет совместного использования электронов или за счет переноса электронов от атомов до полного октета и достижения стабильности.
Что такое химическая связь Строение молекул
Это взаимодействие атомов которая имеет электрическую природу, происходит в результате движения наружных частиц в результате которого происходит перегруппировка электронов.
Атомы в свободном состоянии встречаются в природе очень редко.
Обычно они соединяются или друг с другом, образуя молекулы типа Н2, Р4, Сn, или с атомами других элементов, давая огромное количество самых различных соединений.
В любом случае между атомами в молекулах возникает химическая связь.
Химическая связь имеет электрическую природу. Она возникает в результате движения, перегруппировки электронов во взаимодействующих атомах.
В этом процессе наибольшую роль играют наружные, наиболее подвижные частицы, определяющие периодичность изменения свойств элементов.
Электроны внутренних заполненных уровней в образовании химической связи практически не участвуют.
Атомы могут соединиться и дать устойчивую молекулу только в том случае, если в результате нового распределения электронов будет достигнут выигрыш в энергии.
То есть энергия молекулы, обусловленная взаимодействием ядер и электронов, окажется ниже суммы энергий отдельных изолированных атомов.
Интересный факт: химическая связь необходима для понимания и прогнозирования химических реакций.
Классификация химических связей
Во время образования химической связи материалы участвуют в образовании соединений. Стойкость последующего соединения можно оценить по типу химических связей, которые оно содержит.
Различные типы образующихся химических связей различаются по прочности и свойствам.
Существует четыре основных вида, которые формируются атомами или молекулами с образованием соединений:
1. Ковалентная связь.
2. Водородная связь.
3. Полярная связь.
4. Ионная связь.
Ионная связь
Этот тип химической связи включает перемещение электронов от одного атома или молекулы к альтернативному атому.
В это время атому не хватает электрона, который последовательно добавляется соседним атомом.
Как только происходит такой перенос электрона, один из атомов создает отрицательный заряд и называется анионом.
Дополнительный атом приобретает положительный заряд и называется катионом.
Ковалентное связывание
Ковалентная связь определяет распределение электронов между атомами. Соединения, состоящие из углерода (также известные как органические соединения), обычно демонстрируют такого рода химическую связь.
Два электрона, которые объединены двумя атомами, теперь распространяются вокруг ядер атомов, что играет важную роль в формировании молекулы.
Полярно — Ковалентная связь
Природа ковалентных связей такова, что они могут быть как полярными, так и неполярными.
Электроны соединяются неравномерно в полярной ковалентной химической связи, поскольку дополнительный электроотрицательный атом притягивает электрон ближе к себе и дальше от меньшего количества электроотрицательных атомов.
Водородная связь
Если провести некоторое сравнение между ионной и ковалентной связью, то водородная связь окажется хрупкой процедурой химического связывания.
Этот вид полярной ковалентной связи между кислородом и водородом заключается в том, что водород приобретает частичный положительный заряд при образовании воды.
Интересный факт: ионные соединения образуют кристаллические решетки из-за сильного электростатического притяжения.
Образование молекулы водорода
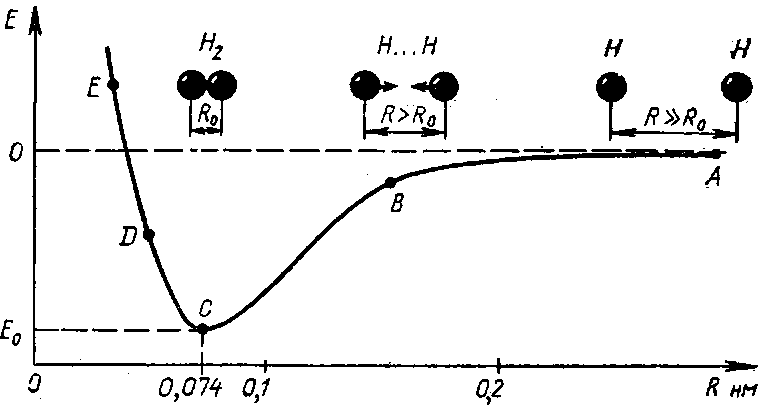
Примером может служить образование молекулы водорода Н2 из отдельных атомов водорода. Не учитывая пока способа, которым они соединяются, будем следить за изменением потенциальной энергии (U) системы, состоящей из двух атомов H+H, в зависимости от расстояния R между ними (рис.).
Рис. Образование молекулы водорода
Удаленные друг от друга на значительное расстояние атомы водорода не взаимодействуют; потенциальную энергию всей системы можно в этом случае условно приравнять к нулю.
При сближении свободных атомов до расстояния, меньшего ~0,2 нм, между ними начинают действовать силы притяжения, что сопровождается понижением потенциальной энергии (участок А→В→С).
При дальнейшем сближении атомов притяжение усиливается (вплоть до R = R0 = 0,074 нм).
В этот момент силы притяжения уравновешиваются силами отталкивания одноименно заряженных электронных облаков и потенциальная энергия принимает минимальное значение Umin.
При R<R0 силы отталкивания резко возрастают. Это приводит к быстрому увеличению потенциальной энергии (участок c→d→e), и атомы водорода возвращаются к наиболее устойчивому положению, характеризующемуся минимумом потенциальной энергии системы.
Интересный факт: прочность химической связи можно измерить с помощью энергии связи или энергии диссоциации связи.
Образование многоатомных молекул
Образование любых других двухатомных или многоатомных молекул также сопровождается понижением потенциальной энергии всей системы взаимодействующих атомов.
Графически это выражается наличием минимума на кривой зависимости потенциальной энергии от межатомного расстояния.
Величина минимума («потенциальная яма») характеризует относительную прочность образовавшейся молекулы и называется энергией химической связи.
Она численно равна работе, которую необходимо затратить, чтобы разъединить связанные между собой частицы (атомы или ионы) на бесконечно большое расстояние, где их взаимодействием можно пренебречь.
Единицей измерения энергии химической связи в системе СИ является дж/моль.
Расстояние R0 между атомами, на котором силы притяжения уравновешены силами отталкивания и которому соответствует минимум потенциальной энергии системы, называется длиной химической связи или межатомным расстоянием.
Энергия и длина химической связи являются ее важнейшими количественными характеристиками. Например, в молекуле водорода длина связи Н—Н равна 0,074 нм, а ее энергия — 432 кдж/моль.
Перераспределение электронов между взаимодействующими атомами может приводить к появлению двух крайних типов химической связи.
При переходе электронов из оболочки одного атома в оболочку другого атома образуется ионная связь; возникающие ионы стягиваются за счет электростатических сил.
Если же электроны поступают от каждого атома в общее пользование, получается ковалентная связь.
Движущей силой этих процессов является стремление каждого атома окружить себя устойчивой электронной оболочкой ближайшего инертного элемента. При этом достигается выигрыш в энергии.
Однако, как мы далее увидим, такое рассмотрение механизмов формирования химической связи является упрощенным.
Правило октета
Правило октета гласит, что атомы объединяются либо путем переноса валентного электрона (ов), либо путем совместного использования валентных электронов (ов).
С образованием молекул путем завершения октета электронов в их валентной оболочке для достижения ближайшей конфигурации благородного газа (элемент водорода завершает свой дуплет для достижения конфигурации гелия).
Ограничения правила октетов
Неполный октет: Центральный атом некоторых молекул имеет неполный октет, т. е. менее восьми электронов в их валентной оболочке.
Обычно это наблюдается в молекуле элементов, которая имеет менее четырех валентных электронов.
Пример: BeCl2 (2 электрона валентной оболочки в Be), BF3(3 электрона валентной оболочки в B), LiH (1 электрон валентной оболочки в Li).
Молекулы с нечетными электронами: Молекулы, которые образуются из атома, содержащего нечетные электроны в валентной оболочке.
Пример: Молекулы азота — оксид азота (NO) и диоксид азота (NO2).
Расширенный электрон: Молекулы некоторых элементов содержат более восьми электронов в валентной оболочке центральных атомов.
Элементы с 3-м периодом и далее имеют d-орбитали, которые также участвуют в химической связи.
Пример: BrCl3 XeF2, PCl5, SF6
Соединения благородных газов: Благородные газы имеют полный октет, но некоторые благородные газы, такие как ксенон и криптон, образуют соединения с фтором и кислородом.
Пример: XeOF2, XeF6, KrF2, XeO3
Точечные структуры Льюиса
Г.Н. Льюис предложил обозначения для обозначения элементов с их валентными электронами. Валентные электроны представлены точкой вокруг символа элемента.
Пример:
Молекулы также могут быть представлены обозначениями символов Льюиса , в которых:
1. Каждый атом разделяет один электрон, образуя электронную пару.
2. Каждая электронная пара представляет собой связь.
3. Атомы объединяются, образуя конфигурацию газа, и вокруг каждого атома должно быть по 8 электронов.
Пример:
Точечная структура Льюиса молекул Cl2.
Единственная электронная пара между двумя атомами представляет собой единственную ковалентную связь.
Пример: H2O, NH3.
Двухэлектронные пары, разделяемые двумя атомами, представляют собой двойную связь.
Пример : O2, CO2.
Три электронные пары, разделяемые двумя атомами, представляют собой тройную связь.
Пример: CO, C2H2, N2.
Ковалентная связь
Ковалентная связь образуется путем обмена электронами между двумя атомами. Атомы объединяются, чтобы стать стабильными, достигая конфигурации, близкой к конфигурации благородного газа.
Одинарная ковалентная связь образуется, когда между атомами разделяется одна электронная пара.
Двойная ковалентная связь образуется, когда разделяются две электронные пары, и тройная связь образуется, когда разделяются три электронные пары.
Ионная или Электровалентная связь
Ионная химическая связь образуется путем переноса электрона (ов) от одного атома к другому и становится стабильной при достижении ближайшей конфигурации благородного газа.
Потеря электрона (ов) атомом образует положительно заряженный ион, известный как катион, а приобретение электрона (ов) образует отрицательно заряженный ион, известный как анион.
Между катионами и анионами существует сильная электростатическая сила притяжения, эта сила и является ионной связью.
Условия образования ионных связей:
1. Низкая энтальпия ионизации катиона.
2. Высокое сродство аниона к электрону.
3. Высокая энергия решетки ионного кристалла.
Энтальпия ионизации: Это количество энергии, необходимое для удаления слабо связанных электронов из изолированного газообразного состояния атома.
M(g) ⟶ M + (g) + eー
Энтальпия поглощения электронов: Это количество энергии, выделяющейся при поглощении электрона атомом газовой фазы в его основном состоянии.
X(g) + eー ⟶ X(g)
Энтальпия решетки: Количество энергии, необходимое для полного разделения одномольного ионного кристалла на составляющие его ионы в газообразном состоянии, известно как энтальпия решетки ионного кристалла.
Чем больше энтальпия решетки ионного кристалла, тем выше стабильность ионно-ионного кристалла.
Фактор, от которого зависит энтальпия решетки ионного кристалла:
Размер ионов: Чем меньше размер ионов, тем больше будет энтальпия решетки.
Заряд на ионах: Чем больше заряд на ионах, тем сильнее будет межионное притяжение и, следовательно, больше будет энтальпия решетки.
Часто задаваемые вопросы и ответы?
Взаимодействие атомов, обусловливающее устойчивость молекулы или кристалла как целого. Химическая связь определяется взаимодействием между заряженными частицами (ядрами и электронами). Современное описание химической связи проводится на основе квантовой механики.
Ковалентная связь. Водородная связь. Полярная связь. Ионная связь.
Ковалентная связь, возникающая между атомами неметаллов с одинаковой электроотрицательностью, называется ковалентной неполярной связью, а между атомами с разной электроотрицательностью — ковалентной полярной связью.


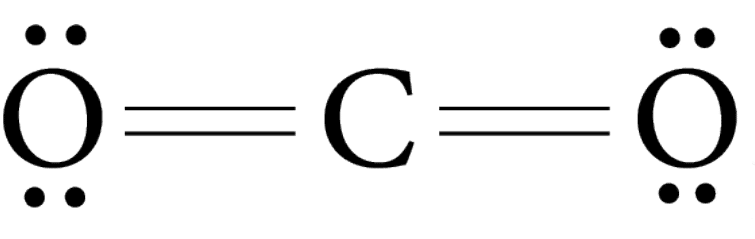
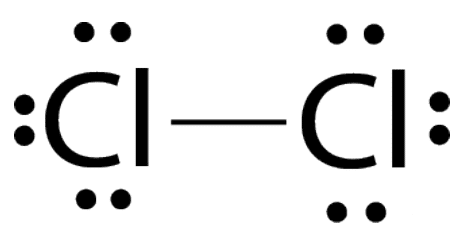
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.