Коррозия металлов и защита металлов от коррозии
[no_toc]
Коррозия металлов это химический процесс разрушения, под воздействием окружающей среды который может протекать самопроизвольно или принудительно.
Что характерно для самопроизвольного окисления, что на момент окисления могут сразу действовать несколько факторов или только один, к примеру на больших предприятиях особенно связанные с химической промышленностью металлические конструкции из железа подвергаются нескольким факторам, это вода, кислоты и проходя через железо ток образует так называемый (блуждающий ток), в таких конструкциях коррозия металла проявляется ржавчиной и небольшими круглыми выемками.
Принудительная коррозия добивается тем, что металл подвергается температурному или химическому воздействию. Разница между самопроизвольной и принудительной коррозией в том, что все происходит при не зависящих от человека обстоятельствах, а при принудительной мы заставляем это сделать.
По химическим свойствам железо является весьма активным металлом. В отсутствие влаги железо на воздухе не изменяется, но при воздействии влаги и кислорода воздуха подвергается сильной коррозии и покрывается рыхлой пленкой ржавчины, представляющей собой гидроокиси железа, которые не защищают его от дальнейшего окисления, и железо постепенно окисляется во всей своей массе:
4Fe + 2Н2О + 3О2 = 2Fe2O3 · 2H2O
Разработан ряд методов защиты этого ценнейшего металла от коррозии.
Условия коррозии металлов
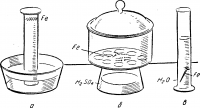
Длительные опыты закладывают на одном уроке, наблюдения проводят в течение нескольких дней.
На рисунке 2 изображены: коррозия железа (стали) во влажном воздухе (а); отсутствие коррозии в сухом воздухе (б); отсутствие коррозии в воде, лишенной воздуха (прокипяченной) (в).
Рис. 2. Опыты по коррозии металлов:
а) коррозия железа во влажном воздухе, б) отсутствие коррозия в сухом воздухе, в) отсутствие коррозии в прокипяченной (без воздуха) воде.
Закладывают опыты для выяснения роли электролитов в коррозии железа. С этой целью опускают очищенные гвозди в разбавленные растворы солей (хлорида магния, хлорида натрия, солей, входящих в состав морской воды), гидроксида натрия, соляной кислоты, водопроводной воды. Начало коррозии может быть обнаружено уже спустя 10—15 мин по появлению в растворе ионов Fe2+, обнаруживаемых по посинению жидкости от прибавленных нескольких капель реактива калия гексацианоферрата (III) (K3[Fe(CN)6]). При стоянии коррозия усиливается.
Электрохимическая коррозия
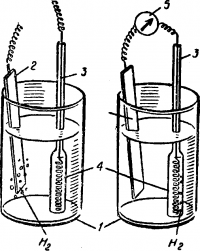
Если соединить между собой цинковую пластину и медную проволоку, то водород в этом случае выделяется уже не на цинке, а на меди — образовался гальванический элемент. Водород можно собрать, если надеть на стеклянную трубку 4 пробирку. Этот опыт можно поставить в чашках Петри и проецировать на экран с помощью графопроектора. Таким же способом можно продемонстрировать опыты коррозии луженого и оцинкованного железа .
Рис. 3. Схема медно-цинкового гальванического элемента:
1 — стаканы с раствором серной кислоты, 2 — цинковая пластина, 3 — медная спираль, 4 — стеклянная трубка, 5 — гальванометр.
В чашки Петри до половины наливают разбавленный раствор хлорида натрия (или соляной кислоты) и несколько капель раствора гексацианоферрата (III) калия (K3[Fe(CN)6]). Укрепляют в скрепки или в расщепы стальных перьев расплющенные кусочки олова, цинка. Опускают их в чашки Петри с растворами так; чтобы они были в них погружены. Через некоторое время в чашке, где было железо в контакте с оловом, появится синее окрашивание: В образовавшемся гальваническом элементе более активный металл — железо — переходит в раствор в виде ионов Fe2+, которые и обнаруживаются по выпадению осадка синего цвета —Fe3[Fe(CN)6]2.
Во второй чашке образуется белое вещество — продукт взаимодействия ионов, перешедших в раствор, так как цинк более активный металл, чем железо. Но как только весь цинк прореагирует, заканчивается его защитная роль («оцинкованное железо») и в раствор начнут переходить ионы железа — появится синее окрашивание.
Процессы, происходящие при коррозии луженого и оцинкованного железа, следует разобрать с помощью графиков и уравнений химических реакций.
Коррозия железа в кислой среде
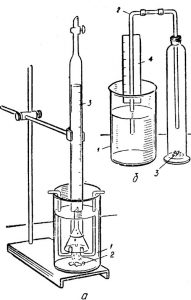
Аналогичный опыт представлен на рисунке 23, б — коррозия железных опилок в нейтральной среде.
Рис. 4 Скорость коррозии железа:
а — в кислой среде: 1 — стакан с раствором кислоты, 2 — образец металла, 3 — бюретка: б — в нейтральной среде: 1 — стакан с дистиллированной водой, 2 — газоотводная трубка, 3 — цилиндр с влажными опилками, 4 — шкала для наблюдения за скорость поглощения кислорода (воздуха).
Процесс газовой коррозии можно проследить по уменьшению содержания кислорода в колбе. Колбу слегка нагревают для ускорения реакции окисления железа при закрытом зажиме. После охлаждения зажим открывают и наблюдают поднятие жидкости в трубке.
Замедлитель коррозии
Рис. 5. Влияние ингибиторов на коррозию железа.
Как остановить коррозию металла
Для замедления коррозии используют специальные краски на основе окислов железа и свинца на масляной основе или же покрывают слоем до 0,3 мм в агрессивной среде (химическая промышленность, места где на металл рассчитана более большая нагрузка в виде изгибания, растяжения) эпоксидной смолой или на его основе краски.
Хорошо зарекомендовал себя способ предварительного нанесения слоя меди с последующим окрашиванием красками на основе эпоксидной смолы или резинового клея, последний применяют в производственных масштабах для защиты металлических конструкций охладительный установок (градильня).
В местах где не возможно допущения коррозии (установки с пониженными температурами, холодильники на основе жидкостей) применяют медные трубки с нанесенные на поверхность слоя золота.
Статья на тему Коррозия металлов


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.