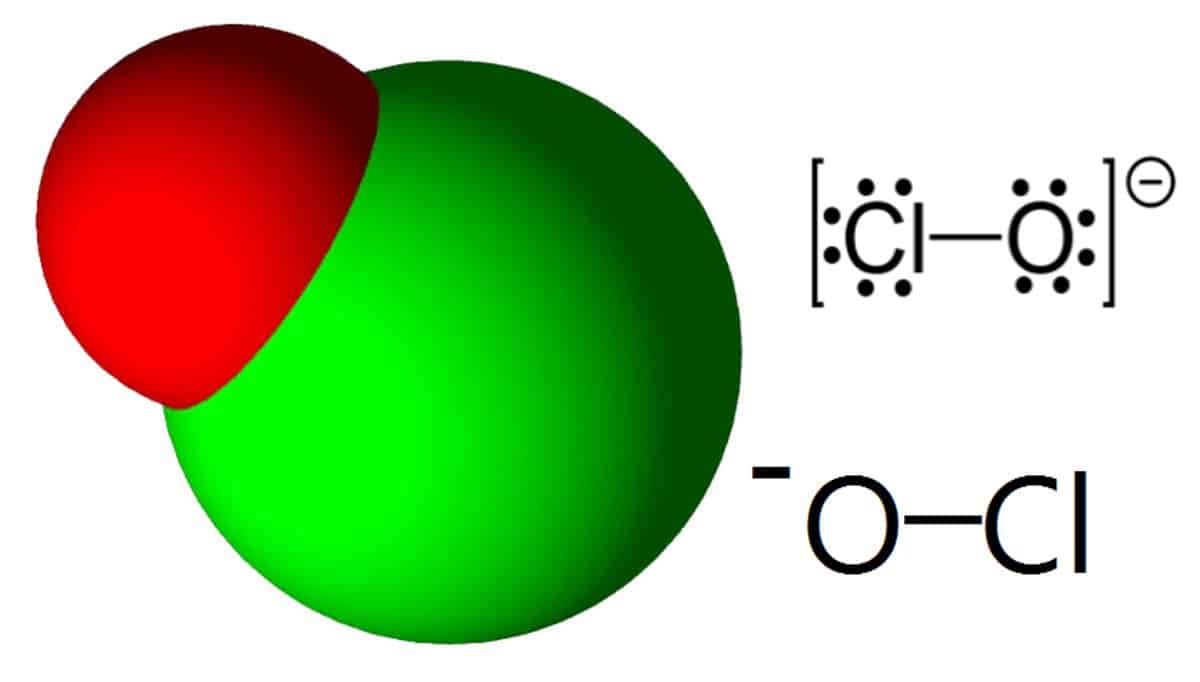
Гипохлорит в химии описывается как анион, имеющий химическую формулу ClO—.
Он соединяется с несколькими катионами с образованием гипохлоритов, которые также можно рассматривать как соли хлорноватистой кислоты.
Распространенными примерами являются гипохлорит кальция (компонент отбеливающего порошка), гипохлорит натрия (бытовой отбеливатель).
Это также может относиться к гипотетическим сложным эфирам хлорноватистой кислоты, а именно к органическим соединениям, имеющим группу ClO— ковалентно связанную с остальными молекулами. Трет-бутил является основным примером гипохлорита, полезного хлорирующего агент.
Свойства
Химическая формула ClO—. Молекулярная масса гипохлорита — 51,449 г /моль. Температура кипения — Разлагается при 40 ° C.
Кислотная реакция
При подкислении гипохлоритов образуется хлорноватистая кислота. Она находится в равновесии с газообразным хлором, который может выделяться из растворов.
Кроме того, равновесие подчиняется принципу Ле Шателье; следовательно, высокий pH переводит реакцию в левое русло за счет потребления ионов H+.
Способствуя диспропорционированию хлора в гипохлорит и хлорид, тогда как низкий pH переводит реакцию в правое русло, способствуя выделению газообразного хлора:
2H+ + ClO— + Cl— ⇄ Cl2 + H2O
Хлорноватистая кислота также будет существовать в равновесии со своим ангидридом, который представляет собой монооксид дихлора:
2HOCl ⇄ Cl2O + H2O K (при 0°C) = 3,55 x 10-3 дм3 моль-1
Стабильность
Как правило, гипохлориты могут быть нестабильными и некоторые соединения существуют только в растворе.
Гипохлорит кальция Ca(OCl)2, гипохлорит бария Ba(ClO)2, гипохлорит лития LiOCl были выделены в виде чистых безводных соединений.
Здесь все они являются твердыми веществами, где еще несколько могут быть получены в виде водных растворов. Как правило, чем больше разбавление, тем выше их собственная стабильность.
Невозможно определить тенденции для солей щелочноземельных металлов, поскольку многие из них не могут быть произведены.
О гипохлорите бериллия ничего не известно, а чистый гипохлорит магния получить невозможно; тогда как твердый Mg(OH)OCl известен.
Гипохлорит кальция может быть получен в промышленных масштабах, и он обладает хорошей стабильностью.
Однако стабильность гипохлорита стронция (Sr(OCl)2) еще не определена и недостаточно хорошо охарактеризована.
Гипохлорит-ион может быть нестабильным в отношении диспропорционирования.
При нагревании он разлагается до смеси кислорода, хлорида, а также других хлоратов, как указано ниже:
2Cl— → 2Cl— + O2
3 OCl— → 2Cl— + ClО3—
на этом основано получение хлората калия (KClO3).
Эта реакция является полностью экзотермической, и в случае концентрированных гипохлоритов, таких как LiOCl и Ca(OCl)2, может привести к опасному тепловому выбросу, включая потенциальные взрывы.
Стабильность гипохлоритов щелочных металлов снижается вплоть до группы.
Безводный гипохлорит лития становится стабильным при комнатной температуре; но гипохлорит натрия не был получен более сухим, чем пентагидрат (NaOCl· (H2O)5).
Хотя более разбавленные растворы, используемые в качестве бытовых отбеливателей, обладают лучшей стабильностью, при температуре выше 0 ° C она нестабильна.
Гипохлорит калия (KOCl) известен только в растворе.
Гипохлориты лантаноидов также нестабильны, и сообщалось, что они более стабильны в своих безводных формах, чем в присутствии воды.
Этот гипохлорит также использовался для окисления церия с его степени окисления от +3 до +4.
Хлорноватистая кислота сама по себе нестабильна в изоляции, поскольку она разлагается с образованием хлора.
Применение гипохлорита ClO—
Гипохлорит может использоваться в качестве хлорирующих агентов. Они также обладают способностью хлорировать ароматические углеводороды, которые богаты электронами.
Он может быть использован для окисления первичных спиртов до карбоновых кислот в органической химии.
Он также является сильным окислителем и может быть использован в реакции эпоксидирования Якобсена, чтобы помочь в превращении Mn (III) в Mn (V).
В домашних условиях его можно использовать для удаления пятен.
Гипохлорит кальция и натрия используется для отбеливания одежды.
Гипохлориты можно использовать для осветления цвета волос.
Промышленное и бытовое применение гипохлоритов
Гипохлориты, особенно натрий (жидкий отбеливатель или вода Javel) и кальций (иначе называемый отбеливающим порошком).
Широко используются в промышленных и бытовых целях, осветляют цвет волос, отбеливают одежду и удаляют пятна.
Это первые коммерческие отбеливающие средства, которые вскоре были разработаны в 1785 году после того, как это свойство было открыто французским химиком по имени “Клод Бертолле”.
Опасности для здоровья
При вдыхании и проглатывании гипохлорит токсичен.
Он раздражает слизистые оболочки, глаза и кожу.
При соприкосновении с органическими материалами он может воспламениться.
Его возгорание может усилить горение.
Быстрые ответы?
В качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства
Повторяющийся или продолжительный контакт с кожей может вызвать дерматит. Вещество очень токсично для водных организмов.
1 литр раствора к 10 литрам чистой воды получается раствор с концентрацией по активному хлору ~ 18г/л.