Хлороводород и соляная кислота это сложные неорганические вещества в состав которого входят: водород H и хлор Cl.
Разница между хлороводородом и соляной кислотой в том, что соляная кислота растворена в воде, а хлороводород нет и он находиться при нормальных условиях в виде газа.
Иногда с помощью этого свойства определяется хлороводород или же производиться опыт для собирания из воздуха (табачного дыма).
Для этого берут банку с хлороводородом и закрывают влажной крышкой, сразу же начинается образование соляной кислоты в виде дымки.
Хлороводород
В лаборатории хлороводород получают действием серной кислоты на хлорид натрия:
NaCl + H2SO4 = HCI + NaHSO4
При 700—800° С гидросульфат натрия взаимодействует со вторым молем хлорида натрия:
NaCl + NaHSO4 = HCI + Na2SO4
Поэтому при высокой температуре (в технике) реакция протекает с образованием двух молей хлороводорода и сульфата натрия:
2NaCl + H2SO4 = 2HCl + Na2SO4
Хлороводород — бесцветный газ с резким запахом, раздражает слизистые оболочки, немного тяжелее воздуха, не горит и горения не поддерживает.
Во влажном воздухе он дымит, образуя с водяными парами мельчайшие капли соляной кислоты, имеющие вид тумана (в сухом воздухе этого не происходит).
Химическая формула хлороводорода HCI, молярная масса 36,4606 г/моль. плотность 1.477 г/л, газ (25 °C)
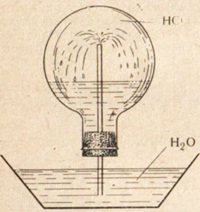
Растворимость хлороводорода в воде очень велика; в 1 объеме воды при 0° С растворяется 507 объемов хлороводорода.
Получающийся при этом раствор называют хлороводородной или соляной кислотой.
Рис. Прибор для наблюдения растворимости в воде хлористого водорода.
Что такое соляная кислота
Это простая двухатомная молекула, состоящая из атома водорода и атома хлора, соединенных одинарной ковалентной связью.
Поскольку атом хлора гораздо более электроотрицателен, чем атом водорода, ковалентная связь между атомами является полярной.
Соляная кислота — это сильная едкая кислота
Раствор хлористого водорода в воде известен как соляная кислота. Его химическая формула — HCl
Она обладает неповторимым резким запахом.
Одним из его распространенных применений является то, что он обычно используется в качестве лабораторного реагента.
Он используется как в водной, так и в газообразной форме.
Химические свойства HCl
HCl — сильная кислота.
Он монопротонный, поэтому может выделять только один протон (H+). В воде он полностью диссоциирует с образованием ионов водорода и хлорида.
Причина, по которой соляная кислота диссоциирует на ионы водорода и хлорида, заключается в том, что она является полярным ковалентным соединением и поэтому при добавлении в воду ионизируется.
Концентрированная соляная кислота может растворять металлы и образовывать окисленные хлориды металлов и газообразный водород.
HCl обладает высокой коррозионной активностью; он воздействует на многие металлы, такие как ртуть, золото, платина, тантал, серебро, и некоторые сплавы являются исключением.
Не вызывает коррозии в присутствии стекла.
Получение
Соляную кислоту получают путем растворения хлористого водорода и воды. Когда газообразный хлористый водород попадает в воду, молекулы воды захватывают атом водорода в HCl (g) и отрывают его от атома хлора.
Это процесс растворения, в результате которого образуется соляная кислота.
HCl + H2O → H3O+Cl−
Хлористый водород также образуется в качестве побочных продуктов при промышленном производстве других химических веществ.
В промышленных масштабах его получают путем сжигания водорода в хлоре. Из-за испарения высокую концентрацию HCl трудно получить.
В технике соляную кислоту получают синтетическим и сульфатным методами.
Синтетический метод состоит из двух процессов: синтеза хлороводорода и поглощения его водой.
Синтез ведут в контактной печи — вертикальной стальной трубе (высота 7 м, диаметр 0,0 м) с горелкой, состоящей из двух трубок ; по внутренней трубке подается хлор, а по внешней водород.
Подожженная смесь горите образованием хлороводорода, направляемого в поглотительную колонну с кислотоупорными кольцами.
Обеспечивающими большую поверхность контакта газа с водой (вода и хлороводород, движутся навстречу друг другу по принципу противотока).
Концентрированная соляная кислота получается в первой колонне (во второй колонне улавливаются остатки хлороводорода).
Синтетический метод удобен, не требует расхода кислот и дешев, необходимые хлор и водород получают электролизом раствора хлорида натрия.
Химически чистая соляная кислота — бесцветная жидкость с резким запахом, содержит 42% НСl (при 18° С).
Концентрированную соляную кислоту, получаемую сульфатным способом, содержащую 37% НСl (пл. 1,19 г/см³ ) и выделяющую на воздухе хлороводород, называют дымящей.
Синтетическая соляная кислота содержит около 31% HCI. Желтый цвет технической соляной кислоты вызывается примесями хлорида железа (III).
Применение соляной кислоты
Соляная кислота является сильной кислотой, поскольку она полностью диссоциирует в воде.
Его можно использовать для получения солей, содержащих ионы Cl-, называемых хлоридами.
Он также используется при титровании для определения количества оснований, поскольку это сильная кислота, которая дает более точные результаты.
Соляная кислота также используется для подготовки образцов при химическом анализе.
Концентрированная соляная кислота способна растворять различные металлы с образованием газообразного водорода и окисленных хлоридов металлов.
Что делает HCl отличным подкисляющим агентом?
Это чистый реагент, с которым обращаться наименее опасно. Он состоит из некоррозионных и нереакционноспособных хлорид-ионов.
Известно, что соляная кислота входит в состав желудочного сока, имеет большое значение для пищеварения человека и животных.
Соляную кислоту используют в производстве красителей, лекарств, хлорида аммония, угольной кислоты , хлора и водорода.
Применяется она в пищевой промышленности и в медицине. Но больше всего расходуется ее на производство хлоридов.
Соли соляной кислоты
Хлорид калия КСl — пенное калийное удобрение. Кроме того, хлорид калия используют в стекольной и химической промышленности.
Может быть получен из солей калия, чистый хлорид калия может быть получен действием на гидроксид калия соляной кислотой:
KOH + HCl = KCl + H2O
Хлорид бария BaCl2 применяется как инсектицид кишечного действия. Может быть получен действием на
Вa(OH)2 + 2 HCl → BaCl2 + 2 H2O
Хлорид ртути (II), или сулема, HgCl2 — сильнейший яд. Сулему используют для дезинфекции в медицине и как протравитель семян в сельском хозяйстве.
Хлорид ртути (I), или каломель, Hg2CI2 не ядовит, применяется в медицине как слабительное.
Хлорид цинка ZnCl2 служит главным образом для пропитывании древесины (шпал-и телеграфных столбов) против гниения, применяется в медицине, а также при паянии.
Хлорид серебра AgCl — один из немногих малорастворимых хлоридов.
Он находит применение в фотопромышленности, так как oбладает светочувствительностью, т. е. свойством разлагаться под действием света с выделением свободного серебра.
Хлорид натрия
Хлорид натрия, или поваренная соль, NaCl — природное сырьё химической промышленности.
Может быть получен из солей натрия или действием соляной кислоты на гидроксид натрия:
NaOH + HCl = NaCl + H2O
Используется в производстве едкого натра, соляной кислоты, хлора, хлорной извести, соды, применяется также в металлургической, кожевенной и мыловаренной промышленности.
Хлорид натрия — приправа к пище и средство консервирования (квашения, соления) продукции растениеводства.
Является неотъемлемой частью жизнедеятельности всех живых организмов.
Cтатья на тему соляная кислота


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.