Что такое чистое железо это чистота выхода при технологической переработке соединений железа , в результате которого получается металл чистотой 99,95% и выше, может быть получено только электролитическим способом.
Поэтому всегда рассматриваются два варианта его получения:
- Пирометаллургический (содержащее до 97%).
- Электролитический (содержащее до 99,95%).
В качестве электролита используют железный купорос FeSО4, либо хлорид железа FeCl2.
Получение чистого железа на производстве
Для получения чистого железа (высокочистого катодного) электролит не должен содержать металлов, более электроположительных, чем железо (медь, никель и др.)
Железо, получаемое пирометаллургическим путем, всегда содержит более или менее значительное количество углерода.
Чистое железо (99,95% и выше) удается получить только электролитическим способом.
Металл, столь необычный для железа степени чистоты, обладает рядом весьма ценных качеств, такими, как высокая пластичность, высокая магнитная проницаемость и пр.
Эти свойства делают его весьма ценным для таких отраслей промышленности, как электротехника и телефония, порошковая металлургия и т. д.
Процессы и скорость электролиза
Стандартный потенциал φ°Fe/Fe2+ = — 0,44 в, т. е. он близок к равновесному потенциалу водородного электрода в нейтральном растворе.
Ток обмена железа невелик и железо выделяется со значительной химической поляризацией.
Перенапряжение же выделения водорода на железе не очень велико.
Поэтому на катоде железо всегда выделяется совместно с водородом.
Чтобы уменьшить величину поляризации железа (увеличить ток обмена) и одновременно сделать возможно более положительным равновесный потенциал железа, следует повысить его концентрацию в растворе.
Большое влияние на совместное выделение железа и водорода оказывает температура. При низких температурах (20—25° С) скорость разряда ионов железа превышает скорость разряда ионов водорода только при низких плотностях тока (до 100 а/м2).
Чтобы получить приемлемый выход по току при высоких плотностях тока, температуру электролита необходимо держать возможно более высокой -85-100°С (рис. 2).
При этих температурах увеличение плотности тока, напротив, ведет к возрастанию выхода по току.
Поэтому электролиз ведут при плотностях тока порядка 500—1000 а/м2.
Резкое понижение выхода по току с увеличением концентрации кислоты в растворе заставляет поддерживать последнюю возможно более низкой.
Однако чрезмерно снижать концентрацию кислоты недопустимо, так как в нейтральных или близких к нейтральным растворам происходит выпадение гидроокиси и основных солей железа.
Чтобы избежать этого, рН электролита поддерживают в пределах 2—3. При этом частичное выделение водорода на катоде неизбежно.
Помимо выделения водорода, на катодный выход по току заметное влияние оказывает реакция восстановления Fe3+до Fe2+.
Основной компонент электролита
В качестве основного компонента электролита могут служить либо железный купорос FeSО4, либо хлорид железа FeCl2.
Катодное железо, полученное из сульфатных электролитов, обычно обладает повышенной хрупкостью, в то время как железо, осажденное из хлорида, имеет высокую прочность.
Кроме того, FeCl2 лучше растворим в воде, чем FeSO4. Поэтому обычно применяют хлоридный электролит.
Помимо FeCl2 или FeSO4, электролит содержит солевые добавки для повышения его электропроводности и немного кислоты или кислой соли для поддержания постоянной величины рН.
Электролитическое рафинирование железа
Для получения чистого железа (высокочистого катодного) электролит не должен содержать металлов, более электроположительных, чем железо (медь, никель и др.).
Кроме того, большая поляризация железа создает возможность для соосаждения и некоторых электроотрицательных примесей.
Большая анодная поляризация при электролизе с растворимыми анодами создает условия для растворения таких электроположительных металлов, как медь и никель, поэтому их не должно содержаться в анодах.
В этом отношении электролиз железа подобен электролитическому рафинированию никеля.
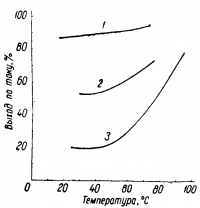
1 — 0,01 н. раствор HCl; 2 — 0,05 н. раствор НСl; 5 — 0,1 н. раствор НСl.
Получение электролитного железа можно вести в ваннах с растворимыми (рафинирование) и нерастворимыми (экстракция), анодами.
Преимущественное распространение получил электролиз первого типа. Анодом при этом служит мягкая мартеновская сталь.
Проведение электролиза с нерастворимыми анодами (свинцовыми— для электролита, содержащего FeSО4 и магнетитовыми или графитовыми, — для электролита, содержащего FeCl2) приводит к образованию свободной кислоты и быстрому падению катодного выхода по току.
Поэтому электролиз приходится вести в ваннах с диафрагмами, причем электролит необходимо часто корректировать.
Основной недостаток получения электролитного железа экстракцией — очень высокий расход электроэнергии, в 8—10 раз выше, чем при электролитическом рафинировании.
Несмотря на то, что в ваннах с растворимыми анодами образования кислоты не происходит, электролиз и в этом случае обычно ведут с применением диафрагм.
Это объясняется тем, что в отсутствие диафрагм остающийся на растворимом аноде мелкодисперсный углеродистый шлам взмучивается конвективными потоками электролита (особенно в горячих растворах) и переносится к катоду, загрязняя катодный осадок.
Рафинировании железа в горячих растворах
При рафинировании в горячих растворах даже при относительно высоких рН происходит значительное химическое растворение железа на аноде.
Поэтому анодный выход по току заметно превышает катодный, а кислота электролита нейтрализуется. Для поддержания постоянного рН в электролит поэтому приходится непрерывно подавать кислоту.
Конструкция ванн для получения электролитического железа может быть различной. Она зависит в основном от формы катодного осадка.
Последний может получаться в виде листов или изделий определенного профиля (труб, лент и пр.).
Ванна для получения обычного катодного листового осадка представляет собой прямоугольный сосуд, выполненный из железобетона с кафельной или гранитной футеровкой, или из эмалированного чугуна.
На дно ванны при электролизе в горячих растворах укладывают змеевик, изготовленный из ферросилиция, по которому пропускают пар для подогрева раствора. Аноды помещают в диафрагменные ячейки.
Процесс электролиза идет с выходом по току в пределах от 75 до 97—99%, обычно он составляет 90—95%.
Напряжение:
- Напряжение на ванне в случае рафинирования в горячих растворах 0,5—1,0 в., удельный расход электроэнергии в первом случае 350—800 квт • ч/т
- В случае электролиза с нерастворимыми анодами 4,5—5,5в, во втором — 4000—8000 квт • ч/т.
Расход соляной кислоты при электролитическом рафинировании в растворе FeCl3 составляет примерно 150 кг на 1 т катодного железа.
Статья на тему Чистое железо


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.