Что такое получение хрома это процесс переработки минеральных соединений хрома хромита FeO • Сr2O3. Некоторое время назад основным методом получения металла был алюмо и силикотермического восстановления окиси хрома.
В настоящее время используются электролиз хромовой кислоты и на основе хромо-аммонийных квасцов.
В лабораторных условиях хром получают восстановление его оксидов алюминием или кремнием.
Хром широко применяется в технике для выплавки жаропрочных и нержавеющих сталей.
Другими областями применения хрома являются получение антикоррозионных покрытий на поверхности металлических изделий (хромирование), производство красок, химическая промышленность.
Получение хрома на производстве
В природе хром встречается преимущественно в виде минерала хромита FeO • Сr2O3. Содержание Сr2O3 в хромитовых рудах обычно составляет 40—55%.
Металлический хром, применяемый для производства специальных сплавов, получался до недавнего времени исключительно путем алюмо- и силикотермического восстановления окиси хрома Сr2O3, получаемой из хромита.
Такой металл содержит ряд примесей, затрудняющих его использование. Это привело к разработке способов электроэкстракции хрома из растворов, позволяющих получить электролитный металл высокой чистоты.
Для получения хрома электролизом применяются два типа электролитов:
- На основе хромовой кислоты.
- на основе хромо-аммонийных квасцов.
Электроосаждение хрома из хромовой кислоты
Электроосаждение хрома из хромовокислого раствора широко применяется для получения хромовых покрытий. Теория этого процесса подробно изложена в разделе гальванотехники.
Осаждение хрома из хромовокислого раствора в качестве металлургического процесса имеет некоторые особенности.
В этом случае стремятся получить мягкие толстые осадки хрома высокой чистоты с возможно низким удельным расходом электроэнергии.
Электроэкстракция из раствора хромовой кислоты проводится в прямоугольных ваннах, футерованных рольным свинцом или фторопластом.
Анодами служат свинцовые пластины, катодные основы изготовляются из нержавеющей стали или алюминия.
Ввиду обильного газовыделения над ванной образуется туман электролита, чрезвычайно вредный для обслуживающего персонала.
Для удаления тумана используется интенсивный бортовой отсос выделяющихся газов.
В ряде случаев в ваннах организуется охлаждение раствора с помощью погруженных водоохлаждаемых теплообменников.
Используемые на практике электролиты содержат 250—350 г/л СrО3 и 2,5—5 г/л H2SO4; обычно отношение СrO3: H2SO4 в растворе равно 100:1.
При получении хрома температура в ванне поддерживается 25—35° С. Плотность тока колеблется в пределах 2800—8000 а/м2.
В этих условиях катодный выход по току (в расчете на шестивалентный хром) составляет от 20 до 35%, напряжение на ванне равно 5—8 е.
Удельный расход электроэнергии при этом составляет порядка 40000—70000 квт • ч/т. Расход хромового ангидрида равен примерно 2—2,5 т на 1 т металлического хрома.
Оксид хрома получение
Хромовый ангидрид для получения хрома электролизом хромовой кислоты производят химическим путем.
Ввиду высоких требований к чистоте СrО3 этот способ получения дорог, и электролитный хром имеет высокую стоимость.
В последнее время разработан процесс получения СrO3 путем анодного растворения феррохрома.
Этот процесс имеет несомненные преимущества, так как в качестве исходного сырья для получения хромового ангидрида используется относительно дешевый и получаемый в больших количествах металлургической промышленностью феррохром.
Электролиз проводят в концентрированных растворах серной кислоты. Аноды отливают из феррохрома, катоды изготовляют из нерастворимого в серной кислоте металла, обычно из свинца.
Главным анодным процессом получения хрома является процесс его растворения и железа. Хром в раствор может переходить в виде ионов Сr6+ и Сr3+.
Шестивалентный хром образует в сернокислом электролите раствор хромового ангидрида, трехвалентный — сульфат хрома Cr2(SO4)3.
Железо переходит в раствор в виде Fe2(SO4)3. На катоде наряду с основным катодным процессом выделения водорода может идти восстановление Сr6+ до Сr3+.
Процесс следует вести таким образом, чтобы предотвратить возможность образования ионов Сr3+. Соотношение в растворе ионов Сr6+ и Сr3+ зависит от концентрации серной кислоты и плотности тока.
С повышением содержания серной кислоты и увеличением плотности тока образование ионов Сr3+ уменьшается, однако одновременно понижается и выход по току за счет пассивации анода.
Вследствие малой растворимости СrO3 в концентрированных растворах H2SO4 большая часть хромового ангидрида выпадает в осадок вместе с Fe2(SO4)3, что затрудняет их разделение.
Наибольшая разница в растворимости СrО3 и Fe2 (SO4)3 наблюдается в 50%-ной серной кислоте.
Пассивация анода в таком растворе крайне незначительна, и возможно получение высоких выходов по току.
Однако в этом относительно слабом по концентрации H2SO4 электролите при электролизе в обычной бездиафрагменной ванне идет образование почти исключительно ионов Сr3+, главным образом за счет восстановления ионов Сr6+ на катоде.
Чтобы предотвратить это восстановление и получить весь хром в виде хромового ангидрида, анод заключают в керамическую диафрагму, препятствующую проникновению ионов Сг6+ в прикатодное пространство.
Плотность тока при проведении анодного растворения феррохрома на указанном режиме должна быть не менее 500—1000 а/м2. В противном случае, несмотря на применение диафрагмы, возможно образование в растворе ионов Сr3+.
Кроме того, понижение плотности тока снижает выход по току. При плотности тока 500—1000 а/м2 выход по току шестивалентного хрома составляет 65—80%.
Электроосаждение хрома хромо-аммонийных квасцов
Этот электролит значительно более доступен и дешев по сравнению с хромовокислым и может быть приготовлен переработкой феррохрома с высоким содержанием примесей, полученного из низкокачественных хромитовых руд.
Суммарной реакцией процесса электроэкстракции хрома из раствора хромо-аммонийных квасцов является реакция разложения сульфата трехвалентного хрома:
Сr2 (SO4)3+3H2O → 2Сr +3H2SO4 + 1,5O2
что аналогично электроэкстракции цинка, марганца и других рассмотренных выше металлов.
Электроосаждение хрома, имеющего ярко выраженный отрицательный потенциал и характеризующегося относительно небольшим перенапряжением для водорода.
В условиях образования на аноде свободной кислоты возможно только при изоляции анодного пространства от катодного и строгом регулировании рН католита.
Поэтому электролиз ведут в ванне с диафрагмой и в электролите с большой буферной емкостью.
Последняя создается добавкой сульфата аммония, что на практике достигается применением хромо-аммонийных квасцов.
Катодный процесс при электролизе сульфата хрома состоит в одновременном протекании реакций:
Сr2+ + 2е ⇄ Сr; φ° = — 0,91 в Сr3+ + 3е ⇄ Сr; φ° = — 0,74 в Cr3+ + е ⇄ Сr2+; φ° = — 0,41 в
При поляризации в первую очередь протекает реакция, как обладающая наименее отрицательным потенциалом.
В отличие от хромовокислых растворов в сульфатном электролите ионы Сr2+ устойчивы, и их концентрация может достигать высоких значений.
По мере накопления ионов Сr2+ и сдвига потенциала катода в отрицательную сторону начинается протекание реакций осаждения.
Одновременно на катоде происходит выделение водорода, снижающее выход по току хрома и вызывающее повышение рН прикатодного слоя.
Уже при рН около 3 происходит выпадение гидроокиси трехвалентного хрома, поэтому нормальный ход процесса требует рН католита порядка 2,1—2,4.
При более низких значениях рН процесс выделения водорода становится доминирующим, и выход по току хрома резко падает.
При наличии буферной добавки (NH4)2SO4 кислотность католита удается стабилизировать в указанном выше интервале рН; выход по току хрома в этих условиях достигает 40—45%.
Катодные и анодные ячейки
На аноде происходит в основном окисление молекул воды с выделением кислорода. Наряду с этим наблюдается анодное окисление хрома с образованием хромовой кислоты.
Последний процесс приводит к почти полному окислению ионов Сr3+, перешедших из катодного пространства в анолит, и последний содержит преимущественно ионы шестивалентного хрома.
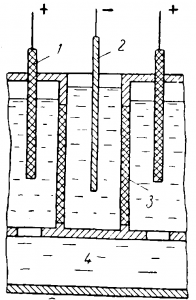
На рис. 2 приведена схема электролизера для электролиза хромо-аммонийных квасцов.
Рис. 2. Схема устройства ванны для электролиза хромо-аммонийных квасцов:
1 — анод; 2 — катод; 3 — диафрагма; 4 — отстойник.
В качестве анодов применяется сплав свинца с серебром (1% Ag); катоды изготовляют из алюминия или нержавеющей стали.
Катодные и анодные ячейки в этой ванне разделены керамическими диафрагмами, причем анодные ячейки с нижней стороны сообщаются с коллектором анолита, из которого отработанный кислый раствор периодически сливают.
Сверху анодные ячейки герметически закрыты и снабжены газоотводами, через которые удаляются анодные газы.
Между анолитом и католитом поддерживается постоянная разница в уровнях для обеспечения протекания католита в анодную ячейку через диафрагму.
Большое внимание должно быть уделено перемешиванию раствора, чтобы предотвратить расслаивание.
Если электролит не перемешивать, то в нижней части его скапливается более кислый раствор. Это приводит к снижению выхода по току и получению неравномерного по толщине осадка.
Электролит для получения хрома
Поступающий в катодные ячейки свежий электролит содержит до 130 г/л хрома (в виде Сr2(SO4)3); содержание сульфата аммония в нем составляет около 120 г/л.
Средний состав католита в ячейке отвечает содержанию порядка 10—15 г/л Сr3+ и 10—15 г/л Сr2+; концентрация сульфата аммония удерживается в нем на уровне 200—250 г/л.
В анолите содержание хрома около 15 г/л, при этом на долю трехвалентного хрома приходится всего около 2 г/л. Концентрация свободной серной кислоты в анолите достигает 280 г/л.
Электроэкстракция хрома ведется при катодной плотности тока порядка 800—1000 а/м2. Температура электролита —50—55° С.
Катодный выход по току (на трехвалентный хром) составляет 40—50%; напряжение на ванне — 4—4,5 в. Удельный расход электроэнергии при этом составляет порядка 18000—20000 квт • ч/т.
Как и при электролизе хромовой кислоты, рентабельное получение металлического хрома из растворов хромо-аммонийных квасцов становится возможным только при наличии достаточно дешевого электролита.
Одним из перспективных способов получения квасцов является электролитический способ. В основе его лежит анодное растворение феррохрома.
Растворение производят в ваннах с анодами, отлитыми из феррохрома, и с железными катодами.
Электролитом служат обычно промывные воды от промывки железного шлама, получающегося при растворении анодов. Промывные воды содержат примерно 4—20 г/л хрома (в виде (NH4)2Cr2O7).
Оптимальными условиями электролиза
Оптимальными условиями процесса можно считать следующие: рН электролита 5—6; анодная плотность тока 1000—1500 а/м2 температура электролита 70—75° С; концентраций Сг6+ в конечном электролите 60—70 г/л.
В этих условиях выход по току Сr6+ составляет 64—68%; напряжение 1 на ванне 6—7 в, удельный расход электроэнергии 30000—35000 квт • ч/т.
Полученный таким образом раствор бихромата аммония (NH4)2Cr2О7 (хроматные щелоки) восстанавливают древесными опилками в присутствии серной кислоты для перевода в хромо-аммонийные квасцы.
Раствор образовавшихся квасцов фильтруют и направляют на кристаллизацию. Кристаллы промывают, растворяют и раствор направляют на электроэкстракцию.
Статья на тему Получение хрома


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.