Получение магния на производстве
Производство магния это процесс электролиза расплавленного хлорида магния, разделяется на несколько этапов:
1. Добыча руд (карналлит или бишофит),
2. Приготовления электролита,
3. Электролиз и рафинирование магния в результате которого получают магний высокой чистоты.
В лабораторных условиях магний получают восстановление окиси магния углеродом можно представить уравнением.
MgO + С ⇄ Mg + СО
Магний относится к числу элементов, весьма распространенных в земной коре, составляя около 2,35% ее веса.
Однако полученный впервые в 1830 г. магний долгое время не имел промышленного значения вследствие больших трудностей при его производстве и из-за недостаточной изученности его свойств.
История получения магния
Мировое производство магния в 1915 г. составляло всего несколько сотен тонн в год. Промышленное производство магния в значительных размерах было организовано в годы первой мировой войны.
После окончания войны выпуск магния сильно сократился и лишь в 30-х годах начался новый рост производства магния, достигший в 1938 г. (без СССР) 23,8 тыс. т, а в 1943 г. 240 тыс. т.
В последующие годы выпуск магния заметно сократился и в 1952 г. не превышал 120 тыс. т.
Рост производства металлического магния сопровождался значительным усовершенствованием электролитического способа его получения из хлоридов.
А также промышленной разработкой и применением термических способов с использованием в качестве сырья магнезита и доломита.
Подробное исследование электролиза расплавленного карналлита было выполнено П. П. Федотьевым и Н. Н. Ворониным в Петербургском политехническом институте в 1914—1916 гг.
Оно послужило основой для организации производства магния в мастерских военно-химического комитета в 1916—1917 гг.
В 1915 г. металлический магний в количестве нескольких сот грамм впервые был получен из русского сырья (хлорид магния из саткинского магнезита) в Петербургском электротехническом институте Н. А. Пущиным и П. Ф. Антипиным.
В 1929 г. в Ленинградском электротехническом институте А. А. Рудницким и А. Ф. Алабышевым под руководством П. Ф. Антипина проведены систематические опыты по получению магния электролизом карналлита.
В более крупном масштабе электролитический метод получения магния из хлорида магния был разработан в 30-х годах в исследованиях ГИПХ, УНИХИМ и ВАМИ. В 1935—1936 гг. были пущены первые заводы металлического магния в бывшем СССР (на Урале).
Работами сотрудников ВАМИ и Гипроалюминия в содружестве с работниками заводов были достигнуты крупные успехи в усовершенствовании интенсификации электролиза магния из хлоридов и в разработке прямого метода восстановления магния из MgO карбо-и силикотермическим методами.
Свойства применение магния
Магний — легкий металл с плотностью при 20° С 1,738 г/см3, с температурой плавления 651°С и температурой кипения 1107°С.
В атмосферных условиях магний при обычной температуре мало изменяется, обнаруживает значительную химическую стойкость, превышающую стойкость железа.
Это происходит вследствие образования на поверхности металла на воздухе тонкого слоя окиси магния.
Обладая высоким электроотрицательным стандартным электродным потенциалом, равным —1,8 в, магний очень слабо взаимодействует с водой вследствие образования труднорастворимой гидроокиси магния.
Кипящая вода разлагается магнием с выделением водорода.
В минеральных и органических кислотах магний растворяется. Но во фтористоводородной и хромовой кислотах устойчив. Щелочи на магний не действуют. В водных растворах солей (кроме фторидов) магний не стоек.
При нагревании в кислороде или в смеси с сильными окислителями магний горит ярким белым светом, что используется в пиротехнике и фотографии.
Обладая большим химическим сродством к кислороду, магний может восстанавливать окислы многих металлов (кремния, бора, алюминия, титана, редких металлов и пр.).
При высокой температуре магний реагирует с азотом, углекислым и сернистым газами.
Из-за высокой реакционной способности чистый магний находит применение в раскислении и модификации специальных сталей.
Сплавов цветных металлов, пиротехнике, магнийорганическом синтезе, дегидратации веществ и в получении тугоплавких металлов, в частности титана.
При сгорании магния развивается высокая температура, что было широко использовано во время второй мировой войны в производстве боеприпасов.
Основная область применения металлического магния — это производство на его основе различных легких сплавов.
Прибавка к магнию небольших количеств специально подобранных других металлов резко изменяет его свойства, сообщая сплаву значительную твердость, прочность и сопротивляемость к коррозии.
Газонепроницаемость сплавов магния и возможность производства разнообразных изделий с помощью всех практикуемых в отношении других металлов технологических методов (отливка, прокатка, прессовка, ковка, резание, штамповка).
Способствуют применению их в самолетостроении, транспортном машиностроении, станкостроении, приборостроении и т. п.
Получение магния электролизом хлоридов
Магний в промышленных условиях был получен впервые электролизом расплавленного хлорида магния.
К которому для снижения температуры плавления электролита и улучшения его физико-химических свойств добавлялись хлориды калия и натрия
Этот способ до настоящего времени сохранил свое значение в производстве магния.
Процесс оказался весьма сложным как в части электролиза, так и в особенности в части подготовки электролита.
Потребовались многочисленные длительные исследования в различных странах мира, в том числе и в СНГ, чтобы сделать этот процесс достаточно рентабельным.
Процесс получения магния из хлоридов состоит из двух циклов:
1. Подготовки электролита,
2. Электролиза.
Кроме того, полученный металл требует переплавки и рафинировки.
Основная трудность в производстве магния из хлоридов заключается в приготовлении электролита, состоящего из безводных карналлита или хлорида магния.
Поэтому в зависимости от исходного сырья разработаны различные технологические схемы приготовления электролита.
Исходным же сырьем могут быть минеральные соли магния, достаточно широко распространенные в природе:
1. Карналлит КСl • MgCl2 • 6Н2O,
2. Бишофит MgCl2 • 6Н2O,
3. Магнезит MgCO3,
4. Доломит MgCO3 • СаСО3 и т. п.
Одним из источником магниевого сырья является морская вода, содержащая наряду с другими солями около 0,3% MgCl2. Больше содержится MgCl2 в воде некоторых соляных озер (до 8—15%).
Морская или озерная вода подвергается выпарке, часто за счет тепла солнечной энергии и концентрированные растворы солей проходят различные стадии переработки для извлечения из нее ценных составляющих (бромидов и некоторых других солей) и освобождения хлорида магния.
Получающийся продукт, шести-водный хлорид магния (бишофит), загрязненный сульфатами и железом, и представляет один из видов сырья для получения магния.
Другим распространенным сырьем для получения магния является карналлитов карналлите содержатся примеси — хлорид натрия, сульфаты и нерастворимый остаток.
Для обогащения природного карналлита по содержанию хлорида магния и очистки от нежелательных примесей его подвергают фракционному выщелачиванию и дробной кристаллизации.
В результате чего получается обогащенный хлоридом магния искусственный карналлит и избыточный хлорид калия.
Подготовка электролита для производства магния
Для производства магния необходимо обезводить как бишофит, так и искусственный карналлит и максимально очистить их от примесей железа и сульфатов.
Процесс обезвоживания относится к одному из наиболее сложных в химической технологии.
При нагревании до 116,7° С из MgCl2 • 6Н2О легко удаляются две молекулы воды и при повышении температуры до 182° С — еще две молекулы воды без существенного разложения MgCl2.
Но удаление последних двух молекул воды требует более высокой температуры и сопровождается гидролизом:
MgCl2 • 2Н2O ⇄ Mg(ОН)Cl + НСl + Н2O
Хлоргидроокись Mg(OH)Cl также разлагается на MgO и НСl при температуре выше 500° С. Поэтому обезвоживание бишофита проводят в две стадии.
Первую стадию обезвоживания ведут в трубчатых (вращающихся), полочных или шахтных печах без расплавления шихты при обогреве их топочными газами от 115 до 350° С.
При этом загруженный в печь дробленый бишофит перемешивается и теряет при нагревании около пяти молекул воды.
Полученный продукт MgCl2 • Н2O содержит 5—7% MgO, образовавшейся в результате частичного гидролиза MgCl2.
Вторая стадия обезвоживания не может быть проведена простым, нагреванием.
Для окончательного удаления воды необходимо принять меры, затрудняющие гидролиз хлорида магния, т. е. смещающие равновесие реакции влево.
MgCl2 + Н2O ⇄ MgO + 2НСl
Для этого возможны различные приемы, обеспечивающие в печи обезвоживания избыток НСl в газовой фазе.
Однако все они связаны с энергичным разрушением аппаратуры в атмосфере влажного хлористого водорода при высокой температуре и не нашли широкого применения в технике.
Значительно проще и без существенного гидролиза хлорида магния протекает процесс обезвоживания карналлита.
Его проводят также в две стадии. В первой стадии карналлит нагревается во вращающихся печах в токе топочных газов, входящих при температуре до 500° С и уходящих из печи при 120—130° С.
При этих условиях удаляют воду до 2—3% содержания ее в продукте. Процесс идет без расплавления карналлита, но со значительным комкованием его.
Вторую стадию обезвоживания осуществляют в пламенных подовых или электрических печах при 800—850° С.
Карналлит расплавляют, обезвоживают, затем добавляет к нему углеродистые материалы для разрушения имеющихся сульфатов:
MgSO4 + C → MgO + CO + SO2
После отстаивания от окиси магния, получившейся от разрушения сульфатов и от незначительного гидролиза карналлита, безводный и очищенный продукт сливают из печи и направляют на электролиз.
Но получение магния электролизом карналлита связано с очень громоздкой технологической схемой обезвоживания в две стадии, так как на 1 т магния нужно обезводить 20—25 т карналлита.
В электролизеры при этой схеме вынуждены заливать около 10 т обезвоженного карналлита на 1 т магния и при непрерывном процессе удалять из них большие количества отработанного электролита.
Весь этот огромный поток сырья можно резко сократить если получать безводный MgCl2 и им питать электролизеры по мере расхода MgCl2.
Поэтому были разработаны способы хлорирования окиси магния, полученной из магнезита MgCO3 или доломита MgCO3 • СаСO3 с участием восстановителя.
Процесс хлорирования проводится в электрических печах шахтного типа при 900—1000°С и может быть описан следующими реакциями:
MgO + C + Cl2 → MgCl2 + CO ∆H = — 34,0 ккал 2MgO + С + 2Сl2 → 2MgCl2 + СO2 ∆H = — 106,4 ккал
При более низких температурах:
MgO + СО + Сl2 → MgCl2 + СO2 ∆H = — 70,8 ккал
Шихту обычно предварительно брикетируют с угольной, коксовой или торфяной пылью.
Для хлорирования используют хлор от электролиза MgCl2. Но использовать его по прямому назначению удается не больше, чем на 75% из-за хлорирования других продуктов шихты, главным образом влаги.
Восполнить потери хлора можно добавкой в шихту для хлорирования еще MgCl2 • 6Н2О или продуктов неполного его обезвоживания MgCl2 • Н2O и Mg(OH)Cl.
В этом случае наряду с хлорированием окиси магния в печи идет и дообезвоживание MgCl2.
За последнее время заводы по производству магния комбинируются с производством титана.
При этом весь анодный хлор от электролиза MgCl2 или карналлита направляется на получение TiCl4 и на производство MgCl2 хлорированием окиси магния хлора не остается.
Необходимо в этом случае вернуться к технологическим схемам, позволяющим получать безводный хлорид магния или карналлит из сырья, содержащего хлор.
Состав и свойства электролита для производства магния
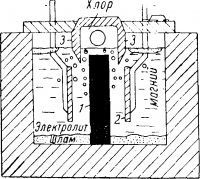
Схема электролизера для получения магния представлена на рис. 2 .
Всплывающий на поверхность электролита металл периодически извлекают из ванны. Выделяющийся на аноде хлор отсасывают в хлоропроводы и транспортируют к потребителю.
По мере расхода хлорида магния новые порции его периодически загружают в ванну, а накапливающийся на дне ванны шлам также периодически вычерпывают.
Температура плавления MgCl2 718° С, поэтому добавки к нему KCl и NaCl играют роль флюсов, снижающих температуру плавления электролита.
Для электролиза обычно используют смеси, содержащие б—15вес.% MgCl2, до 70 вес.% КСl и до 20 вес. % NaCl.
К электролиту обязательно добавляют 1—2% CaF2, который способствует слиянию мелких капель магния в крупные.
Рис. 2. Схема магниевого электролизера:
1 — графитовый анод; 2 — стальной катод; 3 — огнеупорная перегородка.
В процессе электролиза такой смеси на графитовом аноде выделяется хлор, а на катоде только магний, так как напряжение разложения хлорида магния значительно ниже, чем хлоридов калия и натрия.
Для последних при 800° С напряжение разложения составляет величины 3,29 и 3,16 в соответственно.
При той же температуре напряжение разложения чистого MgCl2 равно 2,42 в, возрастая при 700° С и разбавлении хлоридами щелочных металлов до величины около 2,6—2,7 в.
Кроме снижения температуры плавления, солевые добавки к MgCl2 существенно улучшают физико-химические свойства электролита.
Добавка хлоридов калия и натрия повышает удельную электропроводность электролита, которая для указанных выше составов при 700° С составляет от 1,30 до 1,90 ом-1 • см-1.
Для хлоридов калия, натрия и магния, а также для карналлита в табл. 42 приведены значения удельной электропроводности в зависимости от температуры.
Важную роль в получении магния электролизом хлоридов имеет соотношение плотностей магния и электролита.
Необходимо поддерживать температуру и состав электролита такими, чтобы плотность магния была всегда меньше плотности электролита, иначе металл опустится на дно электролизера и будет потерян в шламе.
При 20° С плотность магния равна 1,74 г/см3, а с повышением температуры существенно уменьшается.
C уменьшением содержания MgCl2 в солевой смеси плотность последней снижается.
Поэтому оказалась весьма полезной добавка четвертой соли СаСl2 или ВаСl2, имеющей плотность выше, чем у MgCl2, а электропроводность и напряжение разложения — близкие к таковым для КСl.
Температура плавления смесей четырех хлоридов при замене в указанном выше составе некоторого количества КСl на СаСl2 около 500° С.
Добавки хлоридов калия и натрия уменьшают также вязкость электролита.
Необходимо также отметить, что электролит для получен магния имеет довольно значительное давление насыщенных паров, до 1—2 мм рт. ст. при 700° С.
Вследствие этого, а также от разбрызгивания расплава.
Анодные газы уносят соли, конденсирующиеся на холодных частях хлорпровода, что требует периодической его чистки.
Описанная выше простая схема электролиза осложняется рядом побочных процессов, снижающих выход по току, загрязняющих хлор, разрушающих материалы анода и футеровки ванны и приводящих к образованию шлама.
К таким побочным явлениям относятся главным образом растворимость магния в электролите взаимодействие его с:
1. Анодным хлором,
2. Кислородом воздуха на поверхности электролита,
3. С вредными примесями в электролите — влагой, солями железа и сульфатами.
Хотя растворимость магния в электролите при 700—720° С не велика и составляет около 0,1%, возрастая с температурой.
Однако при неправильной циркуляции электролита и нарушении его состава растворение магния может привести к заметным потерям.
Благотворное влияние добавок фторида кальция (1—2% в электролите) заключается в том, что он растворяет пленку окиси магния на поверхности мелких капель магния, способствуя слиянию их в компактный металл.
С уменьшением поверхности металла резко снижается и его реакционная способность. Такое же влияние оказывают добавки хлоридов кальция и бария.
Наиболее вредная примесь в электролите — влага, попадающая с недостаточно хорошо обезвоженным электролитом и частично поглощаемая им из воздуха.
Опыт показывает, что каждая 0,1% влаги в расплаве снижает выход по току не меньше, чем на 1%.
А при значительных количествах влаги после заливки свежего электролита в ванну выход по току может снижаться до нуля.
Присутствующая в электролите влага может прежде всего вызывать гидролиз хлорида магния с образованием хлористого водорода и окиси магния.
Последняя оседает на дно ванны, а также обволакивает капли металла, препятствуя их слиянию.
Хлористый водород, попадая в анодный газ, загрязняет хлор и содействует разрушению металлических частей ванны.
Влага может также взаимодействовать с магнием:
H2O + Mg → MgO + Н2
Кроме того, влага может разлагаться электролитически с выделением на аноде кислорода, разрушающего графитированные электроды.
Вредное влияние на процесс электролиза оказывают также примеси в расплаве сульфатов, солей железа и бора.
Сульфаты восстанавливаются магнием по реакции:
MgSO4 + Mg → 2MgO + SO2
или
MgSO4 + 3Mg → 4MgO + S
Опыт показывает, что при содержании железа свыше 0,1% выход по току близок к нулю.
Снижение количества железа от 0,1—0,04% приводит к возрастанию выхода по току до 80%.
Железо восстанавливается магнием:
2FeCl3 + 3Mg → 3MgCl2+2Fe
Восстановленное губчатое железо может быть увлечено потоками электролита к аноду, где хлорируется и затем вновь восстанавливается на катоде.
Продукты перечисленных выше побочных реакций приводят к обильному образованию шлама, состоящего из окиси магния, увлеченных на дно капель магния и частичек разрушаемых графитированных анодов и футеровки ванны, пропитанных электролитом.
Шлам необходимо время от времени удалять специальными скребками.
Со шламом (0,3—0,4 кг на 1 кг Mg) теряется большое количество электролита и металлического магния (2—5%).
Анодный газ загрязняется примесями O2, СO2, SO2, НСl и возгоном солей, а, кроме того, присутствие хлористого водорода содействует разрушению металлических частей ванны и хлоропровода.
Вредное влияние оказывает присутствие в электролите соединений бора, даже в количестве около 0,001%.
При этом магний выделяется в сильно распыленном состоянии, увлекается электролитом в анодное пространство, где и сгорает в атмосфере хлора. Выход по току может снижаться до 50—60%.
Рафинирование магния
Полученный электролизом или термическими способами магний-сырец содержит ряд примесей, отрицательно влияющих на его коррозионную стойкость и механические свойства.
Эти примеси можно разделить на металлические и неметаллические. К металлическим относятся Na, К, Са и Fe, попадающие в магний при определенных условиях либо при электролизе, либо путем восстановления их соединений в исходной шихте металлическим магнием.
Основными неметаллическими примесями в электролитическом магнии являются хлориды всех компонентов расплава, захватываемые магнием при извлечении его из ванны. Кроме того, в магнии-сырце встречаются примеси окиси магния, нитриды и карбиды.
Термический магний не содержит хлоридов, но в нем встречаются окислы магния, кальция и железа и нитриды магния.
Общее количество примесей в магнии-сырце может достигать нескольких процентов. Такой металл непригоден для употребления и подлежит рафинированию.
По ГОСТ 804—49 магний марки МГ-1 должен содержать 99,91% Mg и не более 0,09% суммы примесей, в том числе: не более 0,04% Fe; 0,03% Si; 0,005% Cl2; 0,01 % Na; 0,005% К; 0,01% Сu и 0,001% Ni.
По тому же ГОСТ для марки МГ-2 общее количество примесей в магнии допускается не более 0,15%.
Рафинирование магния осуществляют или переплавкой его с флюсами или возгонкой.
В качестве флюсов используют хлориды магния, калия и натрия, иногда также кальция и бария с обязательной добавкой фторида кальция.
Плавку ведут в тигельных печах при 700—750° С. Расплавленный под флюсом металл отстаивается некоторое время под образовавшейся шлаковой коркой, которую затем пробивают и отливают магний в чушки.
Для защиты от коррозии готовые чушки пассивируют в горячем растворе хромпика.
Для получения магния высокой степени чистоты (99,99% Mg) его возгоняют, используя значительное давление паров магния.
При 600° С и остаточном давлении в реторте 0,1—0,2 мм рт. ст. возгонка магния протекает достаточно интенсивно.
Процесс проводят периодически в герметичной, находящейся под вакуумом реторте, нижняя часть которой обогревается и служит сублиматором, а верхняя охлаждается и является конденсатором.
В зоне конденсации при температуре около 500°С магний осаждается в виде друз блестящих кристаллов, содержащих более 99,99% Mg.
Промышленное значение за последнее время получил способ электролитического рафинирования магния, впервые запатентованного Жессупом в 1930 г. и экспериментально разработанного О. А. Лебедевым.
Электролитическому рафинированию подвергают лом и отходы сплавов магния,а также подвергается рафинированию магний-сырец, содержащий в среднем 99,8% Mg.
B первом случае получается металл с содержанием 99,9% Mg, во втором 99,995% Mg.
Статья на тему Производство магния


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.