Состав и свойства электролитов магния
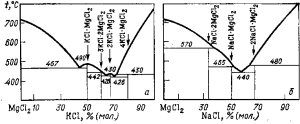
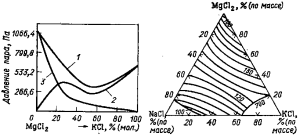
Рис. 79. Диаграммы плавкости двойных систем: а- KC1—MgCl2; б — NaCl—MgCl2
Основные физико-химические свойства отдельных компонентов, входящих в состав электролитов магниевых ванн, приведены ниже:
Компоненты электролита LiCl КСl NaCl
Температура плавления, °С……. 614 770 800
Температура кипения, °С 1310 1500 1413
Плотность, г/см3 . . . . 1,501 1,539 1,549
Вязкость, мПа·с . . . 1,81 1,42 1,49
Удельная электропроводимость, См/м . . . 5,86·10-2 2,42·10-2 3,54·10-2
Напряжение разложения при температуре
700 °С, В……. 3,41 3,53 3,39
Примечание. Значения плотности, вязкости, электропроводимости и поверхностного натяжения даны при температурах, близких к точке плавления соответствующих солей.
Состав и свойства применяемого электролита оказывают сильное влияние на технологические и технико-экономические показатели процесса электролиза магния. Основываясь на изученных физико-химических свойствах расплавов, содержащих тройные и четверные смеси указанных хлоридов металлов, в широком интервале температур и концентраций, можно подобрать состав электролита, обладающего хорошим сочетанием свойств, для проведения электролиза магния в оптимальных условиях. Однако на практике выбор состава электролита в основном определяется составом исходного сырья, технологией его подготовки и качеством получаемого конечного продукта. В каждом конкретном случае, исходя из характеристики загружаемого в ванну сырья, подбирают оптимальный химический состав электролита, т. е. при котором достигаются наилучшие технологические показатели работы магниевого электролизера.
Электролит для электролитического получения магния должен отвечать следующим требованиям: хорошо растворять хлорид магния; его плотность при температуре электролиза должна быть выше плотности расплавленного магния; обладать малой вязкостью и летучестью; как можно меньше взаимодействовать с влагой и кислородом воздуха, а также с футеровкой ванны; хорошо смачивать расплавленный магний; обладать хорошей электропроводимостью и не иметь ионов металлов с более положительными потенциалами выделения, чем магний. В магниевой промышленности нашли
| Поверхностное натяжение на границе с газовой фазой, мН/см . . . | 140,2 | 97,4 | 114,1 |
| Компоненты электролита | MgCl2 | СаСl2 | ВаСl2 |
| 714 | 774 | 962 | |
| Температура кипения, °С | 1412 | 1800 | 1560 |
| Плотность, г/см3 …. | 1,682 | 2,03 | 3,12 |
| Вязкость, мПа·с . . . | 4,69 | 4,20 | 5,25 |
| Удельная электропроводимость, См/м . . . | 1,7·10-2 | 2,02·10-2 | 1,93·10-2 |
| Напряжение разложения при температуре 700 °С, В……. | 2,61 | 3,38 | 3,62 |
| Поверхностное натяжение на границе с газовой фазой, мН/см . . . | 68 | 149 | 178 |
Таблица 17. Основные характеристики электролитов магниевых; ванн
| Свойства электролита | Электролиты | |||
| калиевый | натриево-калиевый | натриево-кальциевыя | натриево-бариевый | |
| Химический состав, % (по массе): | ||||
| MgCl2 | 5—12 | 10-15 | 7—13 | 10—15 |
| NaCl | 10—20 | 45-50 | 48—55 | 48—55 |
| КСl | 65—85 | 30-45 | 4—8 | 10—20 |
| СаСl2 | 1—5 | До10 | 35 | |
| BaCI2 | — | До 5 | _ | 15—30 |
| Температура начала кристаллизации, °С | 650—660 | 625-650 | 575—625 | 675—700 |
| Плотность, г/см3 | 1,56 | 1,63 | 1,73 | 1,85 |
| Превышение плотности электролита над плотностью магния при 700° С, г/см3 | 0,03 | 0,10 | 0,20 | 0,32 |
| Удельная электропроводимость при 700 °С, См/м | 1,7·10-2 | 2,2·10-2 | 2,1·10-2 | 2,3·10-2 |
| Выход по току, % | 76÷80 | 82±2 | 82±2 | 82±2 |
| Вязкость, мПа·с | 1,65 | 1,85 | 2,1 | 1,45 |
| Поверхностное натяжение при 700 °С, мН/м | 120 | 110 | 113 | 113 |
| Удельное количество шлама, кг/1 кт магния | 0,15-0,25 | 0,03-0,06 | 0,2-0,3 | 0,12 |
| Скорость хлорирования MgO 1Обравование оксида магния 2 при продувке расплава воздухом | 8 | 4-6 | 1 | 1 |
| 1 | 1,3-1,5 | 5 | 3—2,5 | |
1 Скорость хлорирования в натриево-кальциевом электролите принята, за 1.
2 Количество оксида магния, образующееся в калиевом электролите,, принято за 1.
применение четыре типа электролита, основные характеристики которых приведены в табл. 17.
При питании электролизера безводным карналлитом применяют калиевый электролит, где содержание NaCl и КСl определяется в основном составом заливаемого расплава и частотой извлечения отработанного электролита. .При питании электролизера безводным хлоридом магния любого происхождения можно применять натриево-калиевый электролит. Преимущество этого электролита заключается в его хорошей электропроводимости, в образовании малых количеств шлама и в оттносительной дешевизне NaCl и КСl (85—90% состава электролита).
Натриево-кальциевый электролит целесообразно использовать при питании электролизера обезвоженным MgCl2, содержащим заметные количества примеси СаСl2, который постепенно накапливается в электролите, например, при загрузке в ванну MgCl2, полученного из магнезита. При загрузке в электролизер хлорида( магния титанового производства иногда применяют нат-риево-бариевый электролит. Во всех случаях в электролит добавляют в небольших количествах CaF2 или NaF, которые способствуют лучшему слиянию капель расплавленного магния.
Плавкость хлоридных систем
Диаграммы плавкости двойных систем КСl—MgCl2 и NaCl—MgCl2 показаны на рис. 79. Из диаграммы плавкости системы КCl—MgCl2 видно, что в этой системе шмеются два химических соединения КО · MgCl2 и
2KCl·MgCl2, которые плавятся конгруэнтно при 490 °С и 430 °С соответственно, и два инконгруэнтно плавящихся соединения —3KCl·2MgCl2 (442 °С) и 4KCl·MgCl2 (430 °С). Точки плавления двойных эвтектик 467, 428 и 426°С и соответствуют содержанию MgCl2, % (моль): 55,5; 36,5 и 31,5.
Система NaCl—MgCl2 имеет три инконгруэнтно плавящихся химических соединения: 2NaO·MgCl2—при 480 °С; NaCl·MgCl2—при 465 °С и NaCl·2MgCl2 — при 570 °С. Эвтектика кристаллизуется при 43% (мол.) MgCl2 и температуре 440 °С.
При выборе калиевого или натриево-калиевого электролита важно знать диаграмму плавкости тройной системы КО—NaCl—MgCl2 представленную на рис. 80. В тройной системе наблюдаются три эвтектические точки. Эвтектика Е1 плавится при 385 °С и имеет следующий состав: 46% (мол.) MgCl2; 22% (мол.) КСl и 32% (мол.) NaCl. Эвтектика £2 имеет состав: 39% (мол.) MgCl2; 26% (мол.) КСl, 36% (мол.) NaCl и температуру плавления 390°С. Эвтектика Е3 затвердевает при 390°С и отвечает составу: 31,5% (мол.) MgCl2; 56% (мол.) КСl и 12,5% (мол.) NaCl. В системе образуется одно инконгруэнтно плавящееся при 398 °С химическое соединение NaCl · КСl ·MgCl2 (S).
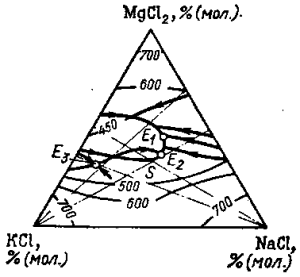
Из рассмотрения диаграммы плавкости системы KCl—NaCl—MgCl? видно, что средняя часть диаграммы состоит из смесей солей, которые имеют сравнительно невысокую температуру плавления. Это позволяет осуществить на практике процесс электролиза магния при рабочих температурах порядка 680—720 °С.
Рис. 80. Диаграмма плавкости тройной системы КСl— NaCl—MgCl2
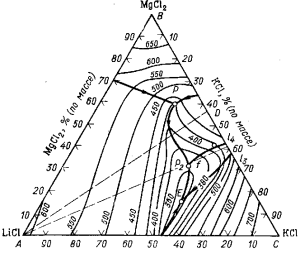
В случае применения литиевого электролита пользуются диаграммой плавкости тройной системы LiCl —KCl—MgCl2, приведенной на рис. 81. В сплавах системы LiCl—KCl—MgCl2 с концентрацией MgCl2 в пределах 8—20% и отношением LiG:KCl>l температура плавления равна 420—570 °С, т. е. намного ниже температуры плавления магния, что дает возможность варьировать состав электролита с учетом других его свойств. Приведенными исследованиями было показано, что литиевые электролиты целесообразно применять, только тогда, когда в расплаве содержится 50-70% LiCl, что позволяет резко повысить электропроводимость электролита.
Плотность и вязкость электролитов магния
При электролитическом получении магния существенную роль играет соотношение между плотностью данного электролита и расплавленного магния. Плотность-электролитов, применяемых в настоящее время, должна быть выше плотности расплавленного магния; при этом магний будет всплывать на поверхность электролита.
Рис. 81. Диаграмма плавкости тройной системы LiCl—КСl—MgCl2.
Отметим попутно, что для оценки скорости всплывания, или седиментации магния в хлоридных расплавах (и) можно использовать формулу Стокса: υ = 2r2(ρм—ρр)q/ /9η, где r — радиус капельки магния; ρм—плотность магния; ρр— плотность расплава; η — вязкость расплава; q — ускорение силы тяжести. На практике надо-иметь в виду, что плотность магния с повышением температуры уменьшается сильнее, чем плотность расплавленных солей, например, карналлита, что иллюстрируется следующими данными:
| Температура, °С………Плотность карналлита, г/см3 …. Плотность магния, г/см3……
Разница между плотностями карнал лита и магния, г/см3……. |
6501,681,6
0,08 |
7001,661,54
0,12 |
7501,641,47
0,17 |
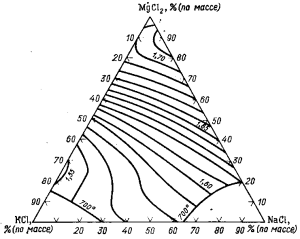
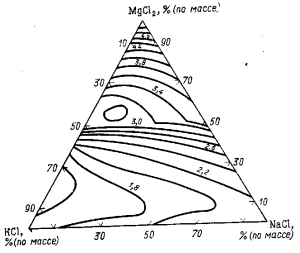
Плотность электролита изменяется в зависимости не только от температуры, но и от состава. На рис. 82 приведены изотермы плотности расплавов системы КCl —NaCl—MgCl2 при 700 °С. С увеличением концентрации MgCl2 и NaCl плотность расплавов данной системы увеличивается. Добавки в электролит СаСl2 или ВаСl2 и CaF2 существенно увеличивают его плотность, что способствует всплыванию капель магния с большей скоростью и отделению их от электролита.
Если плотность электролита мало отличается от плотности магния, то последний всплывает на поверхность расплава с малой скоростью и не собирается в большие массы металла. Малейшее утяжеление капель магния, вызываемое побочными процессами, приводит к тому, что они тонут. Высокая плотность электролита тоже нежелательна, особенно когда магний плохо смачивается расплавом. В этом случае поверхность всплывающих капель магния обнажается, и магний легко окисляется кислородом воздуха. В электролитах с большой плотностью затруднена коалесценция взвешенных частиц оксида магния и других твердых примесей. Оптимальная разница между плотностью электролита к расплавленного магния составляет 0,03—0,15 г/см3.
Рис. 82. Изотермы плотности расплавов системы КСl—NaCl—MgCl2 при 700 °С.
В случае использования литиевого электролита, содержащего 10—20% (по массе) MgCl2 и свыше 60% (по массе) LiCl, плотность его при температуре 700 °С меньше плотности жидкого магния. Выделяющийся на катоде из литиевого электролита магний будет тонуть, и скапливаться на подине электролизера.
Не менее важную роль при электролизе магния играет вязкость электролита: чем меньше вязкость электролита, тем выше скорость коалесценции капель магния и лучше оседает шлам. Вязкость электролита влияет и на его циркуляцию, на выделение и характер движения пузырьков хлора. По этим причинам стараются применять электролиты с наименьшей вязкостью.
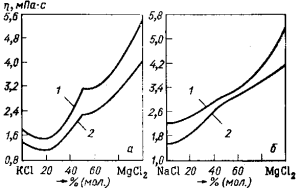
На рис. 83 показаны результаты измерений вязкости двойных систем NaO—MgCl2 и КCl—MgG2. На изотермах вязкости этих систем фиксируются особые точки, отвечающие химическим соединениям KCl·MgCl2 и NaCl·MgCl2.
Рис. 83. Изотермы вязкости расплавов систем: а — KCl—MgCl2; б — NaCl—MgCl2; — 700 °C, 2 — 800 °С
Изотермы вязкости расплавов системы КCl—NaCl— —MgCl2 при 700 °С изображены на рис. 84. Видно, что повышение концентрации MgCl2 в расплаве увеличивает его вязкость. С увеличением содержания СаСl2 и ВаСl2 вязкость электролитов резко возрастает. Повышение температуры понижает вязкость электролитов магниевых ванн.
Давление пара, межфазное натяжение и смачивание
При электролизе магния улетучивание солей электролита приводит к его потерям и отложениям возгонов солей в газоотводящих трубах. Давление пара основных компонентов электролита при температуре электролиза весьма высоко:
MgCl2 KCl NaCl
Давление пара при 750 °С, Па…… 253,3 45,6 47,6
Из приведенных данных видно, что наибольшей летучестью обладает хлорид магния. На рис. 85 показаны изотермы давления пара системы КCl—MgCl2 при 900 °С. Общее давление пара достигает минимума при составе расплава, близком к KCl:MgCl2 (мол) = 1. Парциальное давление пара КCl в этой системе выше, чем MgCl2. В тройной системе КCl—NaCl— MgCl2 наибольшей летучестью обладает MgCl2. Это свидетельствует о том, что MgCl2 прочнее связан в комплексы в двойной системе КCl—MgCl2, чем в тройной КCl—NaCl— MgCl2.
Рис. 84. Изотермы вязкости (мПа·с) расплавов системы КСl—NaCl—MgCl2 при 700 °С
Многие процессы, происходящие в магниевой ванне, связаны с поверхностной энергией на границе раздела фаз. Это — процессы образования пузырьков хлора и капель расплавленного магния на электродах, пропитывания угольных анодов и футеровки ванны солевым расплавом, хлорирование оксидов в электролите и ряд других явлений, наблюдаемых при электролизе магния. Межфазное натяжение на границе электролит — жидкий магний существенно влияет на слияние капель выделившегося магния и на их защиту электролитом от окисления.
Ранее были приведены значения величин поверхностного натяжения некоторых хлоридов на границе с газовой фазой при температурах, близких к точке их
плавления. Изотермы поверхностного натяжения при 700 °С для системы КCl—NaCl—MgCl2 приведены на рис. 86. Наибольшее поверхностное натяжение соответствует расплавам с большей концентрацией MgCl2. Добавка СаС12 и ВаС12 к расплавам системы КCl—NaCl— MgCl2 при постоянном содержании MgCl2 10% мало сказывается на величине поверхностного натяжения, пока концентрация этих добавок не превышает 50%. Неличина поверхностного натяжения расплавленного магния примерно в 4—5 раз больше поверхностного натяжения электролита и составляет при 714 °С 552 мН/м.
Рис. 85. Изотерма давления пара над расплавами системы KCl—MgCl2 при 900 °С % (мол.): 1 — общее давление пара; 2 — парциальное давление пара KCl; 3— парциальное давление пара MgCl2 Рис. 86. Изотермы поверхностного натяжения (мН/м) системы KCl—NaCl—MgCl2 при 700 °С.
Одним из условий получения высоких выходов по току является хорошая смачиваемость стального катода жидким магнием. На смачиваемость влияют не только свойства жидкого металла или расплава, но и свойства поверхности твердого тела. Так, металлы и большинство футеровочных материалов лучше смачиваются хлоридными расплавами, чем углеродистые материалы. Было установлено, что краевой угол смачивания хлоридными расплавами стальной поверхности уменьшается в такой последовательности: MgCl→CaCl2→BaCl2→ NaCl —КCl. На смачиваемость катода жидким магнием могут оказывать влияние и примеси, присутствующие в электролите.
Улучшение смачиваемости электролитом катодной поверхности и жидкого магния ведет в свою очередь к. ухудшению смачиваемости поверхности катода расплавленным магнием. Чтобы улучшить смачивание катодной поверхности жидким магнием, в электролит добавляют поверхностно-неактивные добавки, например, фторид, кальция или натрия. В целом электролит по составу следует выбирать таким, чтобы смачиваемость им поверхности катода была хуже, чем магнием. В этом случае поверхность катода в большей своей части будет покрыта расплывшимися каплями жидкого магния или,, как говорят, лучше «облужена».
Применяемые на практике электролиты, как правило, хорошо смачивают футеровку магниевых ванн, но-при этом происходит и пропитка футеровки расплавом. Скорость и глубина проникновения хлоридного расплава в поры и трещины футеровки тем больше, чем лучше смачивание. Скорость пропитки футеровки электролитом является одним из факторов, определяющих срок службы ванны.
Статья на тему Свойства состав электролитов магния

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.