Минералы магния и магниевые руды

Магнезит представляет собой природный карбонат магния, загрязненный соединениями кремния, железа, алюминия, кальция и марганца. В бывшем СССР месторождения высококачественного магнезита имеются на Урале и в Сибири. Магнезит, используемый в производстве магния, почти не должен содержать примесей. К числу наиболее вредных примесей следует отнести SiO2 и Fe2O3. С целью снижения содержания примесей магнезит подвергают обогащению в тяжелых суспензиях. Иногда магнезит предварительно обжигают при 700— 800 °С для получения оксида магния. Затем сырой или обожженный магнезит в смеси с восстановителем подвергают хлорированию для получения безводного хлорида магния. В настоящее время основное количество добываемого магнезита идет на производство огнеупоров.
Рис. 69. Технологическая схема получения искусственного карналлита
Доломит — двойной карбонат магния и кальция, в котором содержание оксида магния примерно в полтора раза меньше, чем оксида кальция. Использовать его для непосредственного получения электролитического магния нецелесообразно, так как при хлорировании получили бы расплав с низким содержанием MgCl2. Обожженный доломит используется для осаждения гидрооксида магния из хлормагниевых щелоков:
MgCl2 + CaO·MgO + 2Н2O = 2Mg(OH)2 + СаСl2.
Полученный гидрооксид магния в смеси с восстановителем подвергается хлорированию для получения безводного хлорида магния. В бывшем СССР имеются месторождения доломита, имеющие промышленное значение.
Практически неисчерпаемым источником магниевых солей является морская вода и вода соляных озер: в 1 м3 морской воды содержится приблизительно 1 кг магния; концентрация солей магния в воде соляных озер еще более высока. В некоторых странах хлорид магния получают из морской и озерной воды. В нашей стране много соляных озер, но они используются для получения солей магния незначительно.
Бишофит — шестиводный хлорид магния MgCl2·6H2O. В бывшем СССР открыто месторождение бишофита вблизи г. Волгограда. В будущем волгоградский бишофит, в котором содержится около 12% Mg, может служить превосходным сырьем для его получения.
Карналлит — минерал, отвечающий по составу шести-водной двойной соли хлорида магния и калия MgCl2ХКСl·6Н2O. Карналлит находится в природе в виде залежей, состоящих из смеси различных минералов, в число которых обычно входит галит (NaCl), ангидрит (CaSO4) и сильвин (КCl). Наша страна располагает большими залежами карналлитовых руд. Средний химический состав одного из промышленных месторождений, % (по массе): 24 MgCl2; 19 КСl; 24 NaCl; 30 Н2O и 3 нерастворимый остаток. Только в Советском Союзе для производства магния в качестве исходного сырья используется карналлит.
При получении магния электролизом расплавленных солей предъявляются высокие требования к чистоте электролита и постоянству его состава. Поэтому природную карналлитовую руду после дробления и отделения пустой породы направляют на производство так называемого искусственного карналлита.
Основным промышленным способом получения искусственного карналлита является галлургический способ, основанный на различной совместной растворимости MgCl2, КСl и NaCl в воде в зависимости от температуры. С повышением концентрации MgCl2 в растворе растворимость КСl и NaCl понижается, с повышением температуры растворимость NaCl уменьшается сильнее, чем растворимость КСl. При 110—120°С в растворе, насыщенном хлоридами магния и калия, хлорид натрия почти не будет растворяться. После отделения NaCl из раствора при охлаждении будет происходить кристаллизация шестиводного карналлита, точно соответствующего формуле MgCl2·КСl·6Н2O.
Принципиальная технологическая схема получения искусственного карналлита приведена на рис. 69.
Дробленая карналлито-вая руда поступает в вертикальные растворители вместе с горячим маточным раствором, содержащим
32% MgCl2 и около 2% KCl + NaCl, и интенсивно перемешивается при нагревании до 110—115°С. В основном в раствор переходят MgCl2 и КCl, a NaCl и другие нерастворившиеся примеси отфильтровываются. Фильтрат поступает на кристаллизацию, которую ведут в две стадии. Сначала в вакуум-кристаллизаторах раствор охлаждают до 60 °С, где начинают выпадать кристаллы карналлита, а затем в вертикальных кристаллизаторах, охлаждаемых водой. Температуру пульпы снижают до + 20 °С; после декантации и сгущения ее фильтруют на центрифугах.
Полученный таким способом искусственный (обогащенный) карналлит обладает высокой чистотой и постоянной концентрацией основных компонентов и имеет примерно следующий состав, % (по массе): MgCl2 31—32,5; КО 25—26; NaCl 5—6; Н2O 34—36. На производство 1 т искусственного карналлита расходуется 1,5 т природного карналлита, 5 м3 воды, 0,25 т пара и 10 кВт-ч. электроэнергии.
Используют также синтетический карналлит, получаемый конверсией хлормагниевого щелока (отходы химического производства) с отработанным электролитом и техническим хлоридом калия. В синтетическом карналлите содержание хлорида магния на 3—5% ниже» чем в искусственном.
Теоретические основы получения безводных магниевых солей
При производстве магния в электролизер периодически вводят хлорид магния или карналлит, которые должны быть предварительно тщательно обезвожены. Хлорид магния, получаемый из водных растворов, образует в зависимости от температуры ряд гидратов с различным числом молекул кристаллизационной воды.
На рис. 70 показана диаграмма состояния системы MgCl2—Н2O. Каждый гидрат существует только в указанных на диаграмме интервалах температур. Точка перегиба на диаграмме соответствует температурам перехода одной гидратной формы в другую.
MgCl2·12H2O→MgO2·SH2O — 19,4°С; MgCl2·8H2O→ MgCl2·6H2O — 9,4°С; MgO2·6H2O → MgO2·4H2O + + 117°С; MgO2·4H2O → MgO2·2H2O + 184,0°C .
Общепризнано также существование одноводного хлорида магния при температуре выше 184 °С.
Для каждой температуры имеется только одно определенное давление водяного пара, при котором может существовать тот или иной гидрат хлорида магния.
Рис. 70. Диаграмма состояния системы MgCl2 — Н2O
Скорость обезвоживания гидратов хлорида магния будет определяться величиной разности между равновесным давлением водяного пара над данным гидратом и парциальным давлением паров воды в окружающей атмосфере. Процесс обезвоживания ускоряется нагревом гидратов хлорида магния. Однако путем постепенного нагревания не удается полностью удалить влагу, так как процесс дегидратации сопровождается гидролизом хлорида магния. Уже при температуре свыше 184 °С наблюдается разложение двухводного гидрата с образованием гидрооксихлорида магния с выделением хлористого водорода и паров воды: MgCl2·2Н2O⇄ MgOHCl + HCl + H2O. В интервале температур 300÷ 550°С гидролиз хлорида магния определяется равновесной реакцией MgCl2 + H2O ⇄ MgOHCl + HCl с константой равновесия К1 = PHCl/PH2O . При температуре выше 550° происходит распад гидрооксихлорида магния MgOHCl ⇄ MgO + HCl, а при еще более высоких температурах равновесие определяется реакцией MgCl2+ +H2O ⇄ MgO+2HCl с константой равновесия K2 = P2HCl/PH2O. Следовательно, полного обезвоживания MgCl2 простым нагреванием на воздухе достичь невозможно.
Для предотвращения гидролиза MgCl2 необходимо, чтобы равновесие приведенных выше реакций было смещено влево. Этого можно достичь, если в газовой фазе над гидратом хлорида магния отношение парциального давления НС1 к парциальному давлению водяного пара Н2O будет больше константы равновесия реакции при данной температуре, т. е. PHCl/PH2O >K1 и P2HCl/PH2O>К2. Но и в этом случае полностью устранить гидролиз моногидрата хлорида магния не удается. Это объясняется тем, что в системе MgCl2—Н2O образуется твердый раствор гидрооксихлорида магния в хлориде магния. При температурах 300 °С и выше гидро-оксихлорид магния в действительности находится в равновесии не с чистым MgCl2, а со своим насыщенным раствором в MgCl2, что и не дает возможности довести процесс обезвоживания гидрата хлорида магния до конца без его частичного разложения.
При наличии больших количеств НСl в газовой фазе резко снижается степень гидролиза хлорида магния. Степенью гидролиза называется отношение (по массе) количества MgCl2, подвергнувшегося гидролизу, к количеству MgCl2, содержащемуся в исходном продукте. Степень гидролиза можно рассчитать по формуле Г = 2,36-MgO 100/(MgCl2+2,36 MgO), где Г — степень гидролиза, %; MgCl2 и MgO — соответственно содержание хлорида магния и оксида магния в обезвоженном продукте, % (по массе); 2,36 — отношение молекулярных масс MgCl2 и MgO.
Степень обезвоживания — это отношение общего количества воды, содержащейся в конечном обезвоженном продукте (хлориде магния или карналлите), к количеству воды в исходном продукте. Обезвоживание бишо-фита во избежание его интенсивного гидролиза обычно ведут в две стадии: 1) нагревают MgCl2·6H2O в атмосфере воздуха при 170—200°С до получения продукта, содержащего примерно 1,5 моля воды на 1 моль MgCl2; 2) полученный продукт нагревают до более высокой температуры при высокой концентрации НС1 в газовой фазе для получения почти безводного хлорида магния.
Избыток НСl в газовой фазе можно получить, проводя обезвоживание гидратов хлорида магния в присутствии NH4Cl, который при нагреве диссоциирует на аммиак и хлорид водорода. Этот способ обычно применяют для получения небольших количеств безводного хлорида магния, практически не содержащего продуктов гидролиза.
Обезвоживание карналлита также идет в две стадии, но для карналлита этот процесс проходит легче и с меньшей степенью гидролиза, чем для бишофита: 1) MgCl2·KCl·6H2O = MgCl2·KCl·2H2O + 4H2O; 2) MgCl2X XKCl·2H2O = MgCl2·KCl + 2H2O. Переход шестиводного карналлита в двухводный (1-я стадия) идет при температуре 90 °С, переход двухводного карналлита в безводный (2-я стадия) начинается при 150 °С и заканчивается при 200 °С.
Двухводный карналлит плавится при 263,8 °С без разложения. При медленном нагревании карналлита в твердом состоянии в газовой фазе содержатся пары Н20 и НС1. Это свидетельствует о том, что одновременно с реакцией дегидратации протекает и реакция гидролиза карналлита, в результате которой, кроме НСl, образуется гидролизованный карналлит — основная соль типа KMgCl2-x·(ОН)x и гидрооксихлориды магния переменного состава MgCb2-x·(ОН)x. Эти соединения при дальнейшем нагревании термически разлагаются с выделением MgO, так что суммарную реакцию гидролиза карналлита можно представить так: MgCl2·KCl·6H2O = KCl + MgO + 2HCl + 5H2O.
Степень гидролиза при превращении двухводного карналлита в безводный зависит от температуры нагрева и составляет несколько процентов. Хлорид магния при обезвоживании больше подвержен гидролизу, чем карналлит, поскольку активность MgCl2 в карналлите меньше. Так, равновесная концентрация НСl в газовой фазе при обезвоживании карналлита составляет около 51% (объемн.), а для чистого хлорида магния 90% (объемн.) при 700 °С.
Производство безводного хлорида магния
До настоящего времени не разработаны промышленные методы прямого обезвоживания гидратов хлорида магния из-за возникновения сложных технических проблем: сильной коррозии аппаратуры, больших потерь MgCl2 за счет гидролиза, получения Сl2 низкой концентрации и др. Особенно сложно технически осуществить конечную стадию обезвоживания — удаление последней молекулы воды. Это препятствует широкому использованию таких распространенных и доступных источников магниевого сырья, как озерная рапа, морская вода и вторичные хлормагниевые растворы.
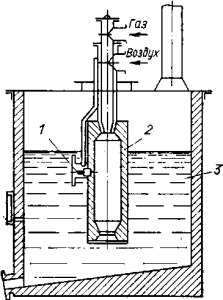
В полузаводских масштабах применяют различные способы получения чистого гидратированного хлорида магния из его растворов. Для получения концентрированных растворов, содержащих до 35—40% MgCl2, а в некоторых случаях даже и выше, применяют выпарные аппараты с погружными горелками. На рис. 71 изображен схематический разрез выпарного аппарата
с погружной горелкой. Горелку располагают в выпарном аппарате таким образом, чтобы камера горения была ниже уровня раствора. Горелку зажигают специальной электрической свечой. Горячие газы, выходящие из камеры горения, сильно перемешивают раствор, одновременно отдавая ему тепло и насыщаясь парами воды.
Рис. 71. Выпарной аппарат с погружной горелкой: 1 — электрическая свеча; 2— горелка; 3— раствор
Но глубокого обезвоживания в данных аппаратах достичь невозможно из-за сильного гидролиза хлорида магния. При обезвоживании бишофита в трехка-мерной печи КС можно получить продукт с — 2 молекулами Н2O со степенью гидролиза 3,5—6,5%. При дальнейшем обезвоживании степень гидролиза резко увеличивается; так, при содержании воды около 1—1,1 молекулы степень гидролиза достигает 32—38%.
Низшие кристаллогидраты из растворов хлорида магния можно получать в распылительных сушилках. Сущность этого способа сводится к распылению горячими газами в смеси с воздухом растворов хлорида магния, удалению избыточной влаги и получению продукта, содержащего примерно две молекулы воды. Недостатком способа является получение тонкодисперсного продукта, сильно гигроскопичного, который требуется гранулировать.
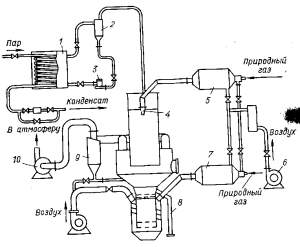
Положительные результаты обезвоживания бишофита были получены на аппарате РКС (распылительная сушилка кипящего слоя (рис. 72). Особенностью аппарата является совмещение в одном агрегате двух процессов: сушки во взвешенном состоянии и грануляции с досушкой в кипящем слое. Исходный раствор хлорида магния насосом подается в бак 1, откуда через питающий контур, состоящий из насоса 3 и напорного бачка 2 сифоном направляется в распылитель 4. Струя раствора распыляется непосредственно топочными газами,
нагретыми до 800—850°С в топке 5. Влажные частицы кристаллогидратов, просушенные до остаточной влаги, обеспечивающей грануляцию, проходя через запыленную среду над поверхностью кипящего слоя, попадают в кипящий слой, где происходит их грануляция и дальнейшее обезвоживание. Из кипящего слоя низшие кристаллогидраты с 1—2 молекулами воды выходят через течку 8, расположенную на уровне решетки кипящего слоя. Газы, пройдя систему очистки 9, выбрасываются
вентилятором 10 в атмосферу. Уловленный в циклоне 9 продукт инжектором вдувается в верхнюю часть кипящего слоя для создания пылевой завесы. Вдуваемая пыль и частицы, поступающие из распылительной сушилки, являются центрами кристаллизации.
Рис. 72. Аппаратурная схема полузаводской установки с аппаратом РКС
Горячие топочные газы из топки 7, разбавленные до заданной температуры воздухом, подаваемым воздуходувкой 6, поступают под решетку кипящего слоя. При получении MgCl·2H2О температура кипящего слоя должна быть 135—140°С, степень гидролиза при этом составляет 4÷5%. При обезвоживании до MgCl2(l,2÷ 1,5)Н2О температуру следует повысить до 150—160°С. При этом степень гидролиза возрастает до 15—20%.
В аппарате РКС сравнительно легко удается получить продукт заданного гранулометрического состава. Полученные низшие кристаллогидраты хлорида магния, содержащие 1,3—1,5 молекулы воды, можно использовать для электролиза магния, загружая их в анодное пространство электролизера. Расход электроэнергии на 1 т получаемого магния при использовании такого сырья повышается. Следовательно, недообезвоженное сырье целесообразно применять при электролизе магния там, где имеется дешевая электроэнергия. Применение недообезвоженного сырья, кроме повышенного расхода электроэнергии, влечет за собой снижение содержания хлора в отходящих газах, увеличенный расход анодов и более интенсивное накопление шлама. Обычно обезвоженный MgCl2, загружаемый в магниевый электролизер, должен содержать не более 0,1—0,2% воды.
Окончательного обезвоживания низших кристаллогидратов хлорида магния можно достичь в токе хлорида водорода или с помощью хлорида аммония. Имеются многочисленные патенты, которые предлагают различные технологические схемы обезвоживания с применением НСl. Все эти предложения технически сложны для промышленной реализации, хотя и позволяют получить безводный хлорид магния.
В процессе обезвоживания растворов хлорида магния в присутствии хлорида аммония обеспечиваются хорошие условия для дегидратации хлорида магния за счет хлорида водорода, выделяющегося при нагреве хлорида аммония. Обычно этим методом предусматривается получение шестиводной соли NH4Cl·MgCl2·6H2О с последующим ее обезвоживанием и разложением. Выделяющийся при разложении соли хлорид аммония улавливается и снова может быть возвращен в процесс для получения новых порций сложной соли. Так как данная соль не плавится в кристаллизационной воде, это позволяет вести процесс обезвоживания при относительно высоких температурах.
Были проведены исследования по получению безводного хлорида магния с применением хлорида аммония в аппаратах РКС и в печах КС. Данный способ получения безводного MgCl2 был испытан в полузаводском масштабе. Испытания полученного продукта в качестве сырья для магниевых электролизеров дали положительные результаты.
Безводный хлорид магния получается как чистый продукт при производстве титана магниетермическим способом. Обычно он используется в качестве сырья в тех магниевых электролизерах, металл из которых поступает на получение титана. Химический состав возвратного MgCl2, % (по массе): MgCl2 97—99; MgO 0,5—1,0; (KCl + NaCl) 0,5—1,0. Концентрация титана, который находится в хлориде магния в виде мелкодисперсных частиц и низших хлоридов, обычно не превышает 0,005%.
Статья на тему Минералы магния и магниевые руды


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.