Гальванотехника
Для гальванических покрытий всегда применяется электрический ток.
В лабораторных условиях гальванотехника применяется в виде предварительно подготовленных солей, которые растворяются в воде и восстанавливаются на металлическом предмете под воздействием электрического тока.
При электроосаждении металлов одной из главных характеристик, определяющих правильность технологического процесса и качество отложения металлов, является их структура.
В гидроэлектрометаллургии основными показателями являются расход электрической энергии на единицу продукции и чистота катодного металла. Это и определяет технологический режим процесса. Что же касается структуры осадка, то требования к ней ограничиваются, главным образом, получением достаточно компактного осадка, не осыпающегося с катода.
При получении гальванических покрытий осадки металлов должны быть по возможности мелкозернистыми, плотными, гладкими, равномерными по толщине. В некоторых случаях ставится задача непосредственного получения зеркальноблестящих осадков. Такие осадки обладают меньшей пористостью и, следовательно, лучше защищают металл от коррозии; они характеризуются также и другими более высокими физико-химическими и механическими свойствами.
Что же касается расхода энергии, то она не играет заметной роли в себестоимости продукции и поэтому при выборе электролита его высокая электропроводность не является главным требованием.
Образование электролитических осадков в гальванотехнике
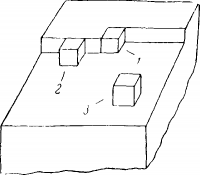
Рис. 2. Возможные участки присоединения нового структурного элемента к растущей грани кристалла.
Кристалл растет за счет присоединений к грани новых структурных элементов, которые удерживаются на ее поверхности силами притяжения. Эти силы простираются на очень малые расстояния, поэтому можно считать, что каждый новый структурный элемент взаимодействует лишь с соседними.
Рассмотрим растущую грань кристалла кубической системы (рис. 2). Новый структурный элемент может занять одно из трех возможных положений. Если принять, что сила взаимодействия между двумя соседними структурными элементами равна величине а, то наибольший выигрыш энергии возможен в том случае, если структурный элемент займет положение 1. В этом случае он соприкасается с соседними структурными элементами тремя гранями и выигрыш энергии составляет 3a. Положение 2 энергетически менее выгодно, так как ему отвечает выигрыш энергии, равный 2а. Самое невыгодное положение 3, где выигрывается лишь величина а.
Соответственно картину роста кристалла можно представить себе следующим образом. Первоначальными активными местами являются вершины углов и ребра кристалла. На этих местах и происходит прежде всего образование новых структурных элементов. Присоединение последующих структурных элементов происходит с большей легкостью, так как это соответствует присоединению их в положении 2. Наконец, когда на поверхности грани образовалась большая совокупность новых структурных элементов появляется возможность многократного присоединения их в энергетически наиболее выгодное положение 1 и образуется слой, который будет разрастаться, заполняя всю поверхность грани. Такое поверхностное образование называется «двухмерным зародышем». Таким образом происходит послойный рост кристалла. Когда вся поверхность грани будет покрыта монослоем новых структурных элементов, возникает необходимость в создании нового двухмерного зародыша в следующем слое.
Изложенные представления о росте кристалла весьма упрощенны. В реальных условиях электролиза мы сталкиваемся с торможением или даже полным прекращением роста кристаллов в результате катодного пассивирования. Пассивирующим фактором может быть, например, адсорбция на поверхности грани поверхностно-активных веществ, находящихся в электролите. Пассивация может иметь место также в результате химического взаимодействия металла с электролитом, приводящего к образованию окисных, сульфидных и других пленок.
Следует также учитывать возможное изменение состава раствора в непосредственной близости от растущей грани кристалла и влияние перемешивания электролита. Большинство этих факторов было принято во внимание в кристаллохимической теории электрокристаллизации металлов, разработанной К. М. Горбуновой и П. Д. Данковым, которая хорошо согласуется с опытными данными. Так, ‘например, эта теория объясняет такие опытные факты как распространение по поверхности кристалла при послойном росте не монослоев, а толстых пакетов толщиной в десятки, сотни и даже тысячи атомов. Создание первоначального двухмерного зародыша протекает, в соответствии с этой теорией, на пассивированной грани, на которой выигрыш энергии может быть меньше, чем величина За, 2а или даже а; однако поверхность только что образовавшегося зародыша не успевает еще запассивироваться и поэтому присоединение к нему нового структурного элемента более энергетически выгодно. Так образуются «двухэтажные», затем «трехэтажные» зародыши и т. д.
По данным А. Т. Ваграмяна, при нормальном росте кристаллов из 3 н. раствора AgNО3 серебро осаждается на растущих кристаллах слоями толщиной 60—120 атомов. При электроосаждении металлов группы железа толщина слоев достигает 1000 атомов.
Установлено, что чем больше толщина слоя, тем меньше скорость распространения слоя по грани кристалла и наоборот. Так довольно толстые слои меди на кристалле меди двигаются со скоростью 0,2 мк/мин.
Как указывалось ранее, наибольший расход энергии связан с началом создания двухмерных зародышей, и он значительно уменьшается, когда на поверхности грани появляется возможность многократного присоединения структурных элементов в энергетически наиболее выгодное положение 1 (рис. 2). Вот почему любые отклонения на поверхности кристаллической решетки, при которых эта начальная стадия становится необязательной, облегчают процесс электрокристаллизации. Это условие выполняется в реальных кристаллах, где в отличие от идеальной кристаллической ре наблюдаются смещения атомов (дислокации). В результате этого на поверхности грани появляются выступы, к которым легко присоединяются структурные элементы, приводя к спиральному росту кристалла.
Следует иметь в виду, что для развития грани кристалла не всегда необходимо предварительное создание двухмерного зародыша. В тех случаях, когда металл осаждается на чужеродном электроде или на электроде из того же металла, но с сильно запассивированной поверхностью, происходит образование трехмерных зародышей.
Образования поликристаллических осадков

Таким образом величина зерна в осадке определяется соотношением скоростей образования кристаллических зародышей и роста сформировавшихся кристаллов. Чем больше скорость образования центров кристаллизации по сравнению с линейной скоростью роста отдельного кристалла, т. е. чем больше кристаллов возникает на покрываемой поверхности в единицу времени, тем мельче кристаллы полученного осадка. В зависимости от плотности тока, скорости диффузии и условий пассивирования чередование процессов зарождения, роста и пассивирования кристаллов может происходить быстрее или медленнее, чем и определяется величина кристаллов в поликристаллическом осадке.
В понятие структуры входит не только размер, но и форма кристаллов. Варьируя состав электролита и условия электролиза, можно влиять не только на размер кристалла, но также на его геометрическую и кристаллографическую форму. Характерным примером изменения геометрической формы в зависимости от условий электролиза является осаждение меди. При осаждении меди из растворов сульфатов и фторборатов без добавок образуются осадки с колончатой структурой. Введение в электролит добавок желатины, фенолсульфоновой кислоты и многих других добавок приводит к образованию волокнистой структуры.
В ряде случаев возможно изменение кристаллографической формы выделяемого металла. Так, например, при электролитическому осаждении хрома можно получить при низких плотностях тока осадки с объемно-центрированной кубической решеткой, а при высоких — с гексагональной плотно упакованной решеткой. При электроосаждении кобальта из сульфатного раствора образуете при определенных условиях смесь кубической и гексагональной фаз, а в присутствии ничтожного количества примеси двухвалентного железа — только кубическая решетка.
Наконец, говоря о структуре, не следует забывать о взаимном относительном расположении кристаллов. Определенная ориентация кристаллов в поликристаллическом осадке называется текстурой. В упрощенной форме разницу между текстурированным и нетекстурированным металлом можно представить с помощью рис. 3.
Рис. 3. Схематическое изображение кристаллов, выделившихся на катоде:
а— неориентированное расположение кристаллов; б —неполная текстура; в — полная текстура.
На рис. 3, а текстура в кубических кристаллах катодного осадка отсутствует. Если условия роста кристаллов таковы, что определенные кристаллические плоскости разных кристаллов оказались параллельными, а остальные элементы симметрии кристаллов расположились относительно друг друга беспорядочно, то образуется неполная текстура (рис. 3,б). Наконец, если большинство кристаллов ориентировано одинаково (соответственные грани и ребра кристаллов параллельны), то такая текстура называется полной (рис. 3, в).
Влияние основных факторов на структуру гальванического осадка
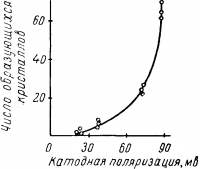
Таким образом все факторы, повышающие поляризацию, способствуют зарождению новых кристаллов и вызывают получение мелкозернистых осадков. Наоборот, с уменьшением катодной поляризации скорость образования кристаллических зародышей понижается и осадок получается крупнозернистым.
Рис. 4. Зависимость числа образующихся кристаллов от катодной поляризации, по данным Ваграняна.
Уменьшение концентрации ионов осаждаемого металла в электролите, увеличение плотности тока, понижение температуры, введение поверхностно-активных веществ повышает катодную поляризацию и способствует образованию мелкозернистых осадков.
Взаимосвязь между катодной поляризацией и величиной кристалла в электролитическом осадке хорошо видна при выделении металлов из растворов простых солей. В зависимости от величины поляризации все металлы могут быть разбиты на три группы.
К первой группе относятся металлы, которые выделяются при потенциалах, близких к равновесным: серебро, свинец, олово, таллий, кадмий.
При обычных в практике гальванотехники плотностях тока эти металлы выделяются в виде отдельных кристаллов дендритной (ветвистой) или игольчатой формы; линейные размеры их достигают 10-3 см и более.
Во второй группе металлов (медь, цинк, висмут) поляризация достигает уже нескольких десятков милливольт; осадки этих металлов уже удовлетворительны по внешнему виду, но еще характеризуются довольно грубой структурой со средними размерами частиц 10-3—10-4 см.
Наибольшей величиной поляризации (десятые доли вольта) сопровождается выделение металлов, относящихся к третьей группе (железо, никель, кобальт). Эти металлы кристаллизуются из растворов простых солей в виде мелкокристаллических (10-5— 10-6 см), плотных и даже при определенных условиях блестящих осадков.
Влияние электролита
С уменьшением концентрации ионов выделяемого металла увеличивается поляризация, скорость образования новых зародышей кристаллов возрастает, и осадок становится более мелкозернистым. А. Т. Ваграмяном на примере электролиза нитрата серебра показано, что по мере разбавления раствора число образующихся кристаллов возрастает. Автор делает вывод, что причиной этого является увеличение активности поверхности электрода в связи с уменьшением в электролите пассиваторов (примесей посторонних веществ).
Не следует, однако, забывать, что разбавление электролита снижает предельную плотность тока, а в ряде случаев заметно уменьшает выход по току. Понизить концентрацию ионов при сохранении общей высокой концентрации соли в электролите можно.
Связывая металл в слабо диссоциированный комплексный анион, или катион, например аммиакатный [Cd(NH3)2]2+ пирофосфатный [Сu(Р2O7)2]6-, цианидный [Ag(CN)2]— и т. д.
В этих условиях процесс разряда сопровождается очень высокой поляризацией, а осадки характеризуются тонкой структурой. Величина зерна при этом настолько мала (10-5—10-6 см), что изучение структуры под микроскопом невозможно и изучение ее приходится проводить рентгеноструктурным методом.
Заметное влияние на структуру оказывает природа аниона простой соли вследствие того, что поляризация металла различна в растворах разных солей. Примером могут служить катодные осадки свинца, получающиеся в виде дендритов или губки из нитратных и ацетатных растворов и довольно гладкими и плотными— в кремне- и бор фтористоводородных растворах.
Повысить поляризацию, а следовательно, уменьшить величину кристаллов, можно также добавлением к основному электролиту (раствору соли выделяемого металла) некоторых солей и кислот. Например, если добавить сульфат натрия к раствору сульфата цинка или никеля, а серную кислоту к раствору медного купороса, то катодная поляризация заметно возрастет и осадки цинка, никеля и меди станут более мелкозернистыми. Н. А. Изгарышев объясняет это различной способностью «нейтральных» ионов дегидратировать разряжающиеся катионы и тем самым изменять скорости электродного процесса. 3 Значение специальных добавок поверхностно-активных веществ и коллоидов. К ним относятся: желатина, декстрин, фенолы, крезолы, нафтолы, их сульфо-производные, тиомочевина, роданиды и др.
Механизм действия коллоидов и поверхностно-активных веществ полностью еще не выяснен. Для объяснения действия таких добавок предложены теория комплексообразования и адсорбционная теория.
Согласно теории комплексообразования, коллоидные соединения образуют комплексы с катионами металлов. Вследствие прочной адсорбционной связи между органическими коллоидами и катионами металлов процесс разряда комплексных ионов замедляется, поэтому разряд металла на катоде в присутствии коллоидной добавки протекает при повышенной поляризации. Поверхностно-активные вещества могут адсорбироваться либо всей поверхностью катода, либо отдельными участками его поверхности. В первом случае разряд катионов осуществляется через сплошную пленку адсорбированного вещества, во втором — разряд катионов и осаждение металла происходят только на свободных участках поверхности катода.
Повышение катодной поляризации при адсорбции поверхностно-активных веществ происходит в результате либо резкого сокращения активной поверхности катода и обусловленного этим местного возрастания плотности тока, либо увеличения энергии активации, необходимой для проникновения катионов через адсорбционный слой к поверхности катода.
Существенное влияние на адсорбционный процесс как в случае ионов, так и в случае нейтральных молекул имеет заряд поверхности металла.
При отрицательном заряде поверхности электростатическое отталкивание будет препятствовать адсорбции анионов и, наоборот, будет усиливать адсорбцию катионов. При положительном заряде поверхности электрода действие электростатических и специфических адсорбционных сил складывается, благодаря чему возрастает адсорбция анионов. Поэтому для определения условий адсорбции при заданном потенциале необходимо знать положение этого потенциала относительно точки нулевого заряда данного металла. Значение этих данных исключительно велико для правильного выбора добавок в электролит, так как они позволяют разграничить области преимущественной адсорбции катионов, анионов и молекулярных веществ.
Адсорбция нейтральных органических молекул наблюдается только в определенном интервале потенциалов, лежащем по обе стороны от потенциала нулевого заряда поверхности электрода; при определенном удалении от нулевой точки (в обе стороны) происходит десорбция органических молекул.
Зная, как протекает адсорбция поверхностно-активных веществ хотя бы на одном из металлов, например на ртути, можно, используя предложенную Л. И. Антроповым [6], приведенную или φ-шкалу, найти наиболее вероятную область потенциалов, в которой следует ожидать адсорбцию тех же самых веществ на поверхности любого другого металла.
Положительное влияние на характер электрокристаллизации оказывают также и коллоидальные взвеси гидроокисей металлов, образующиеся в прикатодной зоне во время электролиза.
Образование гидроокисей металлов происходит обычно в слабокислых или нейтральных средах в условиях совместного выделения металла и водорода, когда в прикатодном слое электролита становится возможным гидролиз. Образующиеся при этом коллоидные взвеси обладают характерными свойствами гелей, адсорбируются на металле и существенно влияют на структуру и свойства электролитических осадков.
Заметное влияние на структуру осадков оказывает растворение в них водорода. Механизм включения водорода в осадок может быть различным. Один из путей попадания водорода в осадок может заключаться в адсорбции атомарного водорода на поверхности в процессе осаждения металла. Адсорбированный водород частично рекомбинируется и превращается в молекулярный водород, а частично переходит в кристаллическую решетку металла, занимая узлы в ней или располагаясь между ними, и образует твердые растворы; возможно также и непосредственное включение иона водорода в кристаллическую решетку в виде протона. Другим путем попадания водорода в металл может быть образование химических соединений металла с водородом — гидридов. Каким путем происходит включение водорода в электролитический осадок в каждом конкретном случае, зависит от природы металла и условий электроосаждения.
Элекроосажденные металлы по-разному поглощают водород. Так, хром содержит около 0,45 вес. % водорода, железо, никель, кобальт до 0,1 вес. %, цинк 0,01—0,001 вес. %; некоторые металлы не поглощают водород (свинец, ртуть).
Несмотря на сравнительно небольшое процентное содержание водорода в металлах, происходит значительная деформация кристаллической решетки. В осадке возникают большие внутренние напряжения, которые являются причиной его отслаивания от основы и повышенной хрупкости. Кроме того, адсорбированный водород, накапливаясь в микротрещинах и порах основы может вызывать образование пузырей и вздутий.
Влияние режима электролиза
Повышение плотности тока приводит к возрастанию поляризации и уменьшению величины зерна в осадке.
А. Г. Самарцев при исследовании осаждения серебра из растворов нитрата серебра показал, что с повышением плотности тока количество образующихся кристаллов серебра возрастает, причем эта зависимость подчиняется линейному закону, и особенно в разбавленных растворах.
Повышать плотность тока можно лишь до предельного значения, после которого наступает нарушение процесса. Вследствие сильного обеднения прикатодного слоя ионами металла наблюдается неправильное отложение металла на краях катода и выступающих участках, в виде ветвистых наростов — дендритов. При еще более высокой (предельной) плотности тока катод покрывается губчатой порошкообразной массой, которая состоит из мелких отдельных кристаллов, непрочно связанных между собой и с основой.
Влияние температуры противоположно влиянию плотности тока. С повышением температуры катодная поляризация уменьшается и осадки становятся более крупнокристаллическими. Возрастает и предельная плотность тока. Такое влияние температуры на катодную поляризацию связано с увеличением скорости диффузии ионов, а следовательно, с уменьшением концентрационной поляризации. Происходит также уменьшение химической поляризации.
В практике гальваностегии учитывается взаимно противоположное влияние температуры и плотности тока, дающее возможность получения мелкокристаллических осадков при работе на интенсифицированном режиме (высокая плотность тока и высокая температура электролита).
В том же направлении как и повышение температуры, влияет перемешивание электролита, снижающее концентрационную поляризацию. Вместе с тем, перемешивание в известной мере компенсирует убыль ионов металла в прикатодном слое и, следовательно позволяет работать при большей плотности тока.
Влияние структуры и материала катодной основы. В образовании поликристаллического осадка большое значение играет акт начального выделения металла на покрываемой поверхности. В зависимости от природы основного и осаждаемого металла, а также от состояния поверхности покрываемого металла электрокристаллизация ,может происходить как на чужеродной поверхности с образованием трехмерных зародышей; однако при определенных условиях металл покрытия может воспроизводить структуру основы.
Воспроизведение структуры наблюдается и при покрытии одного металла другим. Так, кадмий сохраняет структуру олова, олово — структуру свинца, несмотря на то, что кадмий кристаллизуется в гексагональной системе, олово в триклинической, а свинец в кубической.
Влияние структуры основы заметно проявляется при тонких отложениях. С увеличением толщины осадка это влияние постепенно ослабляется и структура осадка приближается к той, которая типична для данных условий электролиза; в дальнейшем характер структуры определяется только условиями электроосаждения металла. Наиболее слабо структура основы воспроизводится после шлифовки и грубой полировки поверхности, а также на поликристаллическом основании с мелкозернистой структурой (величина зерна 10-5—10-6 см). Такую структуру можно получить, например при осаждении меди из цианидного электролита. В этих условиях ориентирующее влияние структуры основы простирается на толщину 0,1—0,2 мк.
Структура и блеск покрытий гальванотехники
Блеск электролитических покрытий может быть достигнут путем механической, электрохимической или химической полировки. Однако при использовании этих методов безвозвратно теряется до 20% от веса покрытия, что приводит к значительному ухудшению защитных свойств покрытия; кроме того, требуются дополнительные расходы на оборудование и материалы, электроэнергию, рабочую силу и др. Поэтому, вопросу получения блестящих покрытий непосредственно при электролизе посвящено много работ. Блестящие электролитические покрытия могут образоваться при электрокристаллизации в электролитах определенного состава и при определенных условиях осаждения.
Блеск металлической поверхности зависит от степени ее гладкости; последняя определяется размерами, формой и расположением элементарных частиц, образующих поверхность металла. В отношении электролитических осадков высказываются различные и зачастую противоречивые взгляды на то, что считать определяющим для их блеска — размер кристаллов осадка или их ориентацию в каком-либо определенном направлении, которое вызывает преимущественное отражение света.
Микроскопические исследования многих авторов показали, что осадки, состоящие из крупных кристаллов, имеют меньший блеск, чем мелкокристаллические осадки; правда, кроме величины кристаллов, имеет значение и плотность их упаковки.
Многочисленные работы по изучению ориентации кристаллов в блестящих и матовых осадках свидетельствуют о том, что прямой связи между блеском и ориентацией нет. Для одних блестящих осадков обнаруживается какая-либо ось текстуры, а для других нет. Так, например, Н. Т. Кудрявцев показал, что блестящие осадки цинка, полученные из сульфатных растворов с добавкой натриевой соли дисульфонафталиновой кислоты, обнаруживают, в отличие от матовых осадков цинка, явно выраженную текстуру с ориентировкой кристаллов по гексагональным осям, в то время как в блестящих осадках никеля, полученных с той же добавкой, кристаллы не имеют никакой ориентации.
Как указывает К. М. Горбунова, для блеска электролитических осадков имеет значение не столько наличие какой-либо оси текстуры сколько ее тип, так что осадки без ориентации кристаллов могут давать лучший блеск, чем неблагоприятно ориентированные. Так, если кристаллы имеют форму куба и плоскости их граней параллельны плоскости основного металла, то даже при относительно больших размерах кристаллов осадок будет более блестящим, чем осадок с выступающими на поверхность вершинами кубов.
Электронно-микроскопические исследования осадков никеля и цинка, выполненные К. М. Горбуновой с сотрудниками, показали, что блеск электролитических покрытий определяется в первую очередь сглаживанием выступающих вершин отдельных кристаллов.
Блестящие осадки никеля, по данным электронно-микроскопических исследований, состоят из округлых кристаллов малых размеров, не имеющих ясно выраженных граней. При электроосаждении в электролитах с блескообразователями радиус этих округлостей возрастает, что способствует увеличению блеска. Что же касается причин образования на катоде блестящих электролитических осадков, то в этом вопросе нет еще ясности.
Согласно утверждения К. М. Горбуновой, образование на катоде блестящих электролитических осадков связано с наличием на поверхности катода пленки, часто коллоидного типа, которая играет определенную роль в подводе разряжающихся ионов к поверхности электрода (так называемый диффузионно-гидродинамический фактор). Другие авторы связывают роль некоторых блескообразующих добавок со скоростью их адсорбции и десорбции на поверхности электрода. Быстрая адсорбция и десорбция молекул поверхностно-активного вещества препятствует осаждению металла в виде крупных кристаллов и способствует сглаживанию поверхности.
Значительная роль в образовании блестящих покрытий отводится гидроокисям металлов, которые образуют в прикатодной зоне высокодисперсные коллоиды.
По мнению Ю. Ю. Матулиса, блескообразующие добавки в электролиты влияют на механизм процесса только путем взаимодействия с коллоидальной гидроокисью металла у поверхности катода. Коллоидная гидроокись, образующаяся в процессе электролиза, способствует образованию блестящих осадков лишь в случае высокой степени дисперсности. Стабилизировать высокодисперсное состояние золя можно введением гидрофильных коллоидов (желатина, альбумин, декстрин, пепсин и т. д.) или блескообразователей, вступающих в химическое соединение с ионами осаждаемого металла и снижающих активность электроосаждаемых ионов; при этом уменьшение активности ионов осаждаемого металла снижает скорость образования гидроокиси в прикатодной зоне, препятствуя тем самым росту образующихся золей. При анализе структуры блескообразующих добавок отмечено частое повторение определенных групп атомов, например: R—SO3H, R—NH2, —CNS, ROH, RS—, R2C = S (где R — нафтил или арил).
Все органические соединения с такими группами являются активными лигандами и способны в водных растворах вытеснять молекулы воды из первой гидратной оболочки многих катионов с образованием одно- и многоядерных комплексов. Ионы Ni, Со, Fe, Си образуют устойчивые комплексы, Zn и Cd — менее устойчивые и почти не дают комплексов Рb и Sn. Поэтому для никеля известно огромное число блескообразователей, для цинка и кадмия — меньше, а для олова и свинца совсем мало.
Структура и механические свойства гальванических покрытий
Как уже отмечалось ранее структура осадков определяет и их свойства. В гальванотехнике представляют ценность лишь те осадки, которые получаются плотными, мелкокристалличными, а в некоторых случаях полублестящими или блестящими.
Не говоря уже о том, что такие требования являются обязательными для декоративных покрытий, условия нанесения защитных покрытий должны удовлетворять им также, ибо химическая стойкость защищаемого металла тем больше, чем плотнее и мельче структура электроосажденного металла; причем еще большую роль структура покрытия играет при осаждении металлов, электроположительных по отношению к основному металлу, например, при свинцевании или лужении железа.
Механические свойства осадков также находятся в зависимости от их структуры. Осадки с крупнокристаллической структурой имеют пониженную твердость по сравнению с осадками мелкокристаллическими. Влияние размера кристаллов на твердость находит объяснение в большем или меньшем развитии границ между ними. При измельчении кристаллов увеличивается общая поверхность раздела, а на поверхности раздела вследствие неуравновешенности силовых полей отдельных атомов неизбежно некоторое искажение кристаллической решетки по сравнению с внутренними слоями кристалла, в которых все силы притяжения и отталкивания уравновешены. К этому еще добавляется возможность существования межкристаллического вещества в виде пленок примесей, обволакивающих зерна. Если эти пленки являются более твердыми, чем сами кристаллы, то увеличение суммарной поверхности раздела также приведет к повышению твердости. Все факторы, способствующие измельчению структуры, вызывают соответствующее повышение твердости осадка, и наоборот.
Существует весьма тесная связь между структурой и внутренними напряжениями в электролитических осадках. Многие электролитические осадки характеризуются наличием значительных внутренних напряжений, которые могут быть вызваны различными причинами: искажением параметров кристаллической решетки или изменением расстояний между кристаллами осадка в процессе осаждения, укрупнением кристаллов осадка вследствие слияния мелких кристаллов и другими. Для большинства металлов наблюдаются внутренние напряжения растяжения, а для некоторых — напряжения сжатия. Так, при электроосаждении хрома, никеля, кобальта, железа, палладия и меди возникают преимущественно напряжения растяжения, тогда как при осаждении цинка, кадмия и свинца — внутренние напряжения сжатия.
В тех случаях, когда напряжения растяжения сильно возрастают, они могут по величине превысить прочность металла на разрыв, и произойдет разрушение электролитического осадка (растрескивание и шелушение). Такое явление можно наблюдать в никелевых электролитах, загрязненных некоторыми органическими веществами или железом.
Состав электролита и режим электролиза оказывают большое влияние на величину внутренних напряжений. Это обстоятельство используется обычно на практике для получения осадков с минимальными внутренними напряжениями. Например, при введении в никелевый сернокислый электролит возрастающих добавок дисульфонафталина, а в медный сернокислый электролит — сегнетовой соли или тиомочевины, напряжения растяжения сначала возрастают, достигают максимума, после чего снижаются и проходя через нулевое значение, меняют знак, переходя в сжимающие.
Таким образом поддерживая определенную концентрацию поверхностно-активных веществ можно получать гальванические осадки с очень малыми внутренними напряжениями.
Статья на тему Гальванотехника


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.