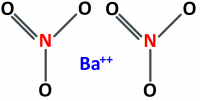
Нитрат бария это сложное неорганическое вещество, в состав которого входят: барий Ва, азот N и кислород О2.
Химическая формула Ba(NO3)2, основное применение для получения веществ на основе бария, примером может служить сульфат бария BaSO4.
Что такое нитрат бария
Нитрат бария это неорганическое соединение, которое официально известно и под многими другими названиями.
Некоторые предпочитают называть его динитратом бария, в то время как другие могут знать это соединение как нитробарит, азотнокислый барий, бариевая селитра.
Однако неофициально люди могут называть это конкретное соединение солью бария.
Формула нитрата бария — Ba(NO3)2, и структурная формула нитрата бария приведена ниже:
Физические свойства
Название IUPAC — барий (2+); динитрат. Молекулярная масса — 261,34 г /моль. Внешний вид — кристаллическое твердое вещество.
Цвет — белый. Горючесть — негорючий. Реакция на тепло — при определенных условиях соль нитрата бария может взорваться. Запах — без запаха.
Температура кипения — соединение разлагается при сильном нагревании. Температура плавления — 592 градуса цельсия или 1098 градусов по Фаренгейту.
Растворимость — хорошо растворим, 10,3 г /100 г воды. Плотность — 3,24 г/кубический см. Давление пара — низкий.
Разложение — разлагается при нагревании с образованием оксидов азота. Показатель преломления — 1.5659.
Интересный факт: интересным свойством нитрата бария является то, что он повышает горючесть других соединений, хотя сам по себе он не является горючим.
Однако следует остерегаться подвергать нитрат бария воздействию высокой температуры в течение длительного времени, поскольку соединение может взорваться или стать пожароопасным.
Кроме того, он действует как окислитель в отдельных химических реакциях; это свойство также находит применение в различных областях применения.
Химические свойствах
Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом.
Смеси с некоторыми органическими материалами склонны к самовоспламенению.
Нагревание свыше 600 °C приводит к разложению вещества:
Ba(NO3)2 → Ba(NO2)2 + O2↑
В результате образуется Ba(NO2)2 нитрит бария и кислород.
Дальнейшее нагревание к разложению:
Ba(NO3)2 → BaO + 4NO2↑ + O2↑
В результате образуется оксид бария, оксид азота и кислород.
Реагирует с серной кислотой:
Ba(NO3)2 + H2SO4 → BaSO4↓ + 2HNO3
Где образуется сульфат бария и азотная кислота.
В водном растворе реагирует с сульфатами:
Ba(NO3)2 + Na2SO4 → BaSO4↓ + 2NaNO3
Образуя сульфат бария и нитрат натрия.
Как получить нитрат бария
Первый Способ
Первый процесс начинается с растворения карбоната бария или BaCO3 азотной кислотой (HNO3):
BaCO3 + 2HNO3 → Ba(NO3)2 + 2H2O + CO2↑
При взаимодействии двух соединений примеси железа осаждаются на поверхности. С помощью технологии фильтрации необходимо удалить эти примеси.
Затем оставшаяся смесь должна подвергнуться выпариванию. Наконец, после кристаллизации мы получаем чистый нитрат бария, который часто используется в промышленности.
Второй способ
Основан на взаимодействием гидроксида с азотной кислотой:
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Этот способ применяется для получения его в лабораторных (домашних) условиях.
Третий способ
Некоторые производители также используют вторичный метод получения нитрата бария.
Включает химическую реакцию между сульфидом бария и азотной кислотой:
BaS + 4HNO3 → Ba(NO3)2 + S(↓) + 2NO2(↑) + 2H2O
Тем не менее, при этом способе производства необходимо внимательно следить за температурой, поскольку высокие температуры могут привести к разложению Ba(NO3)2 на оксид бария, диоксид азота и кислород.
2Ba(NO3)2 → 2BaO + 4NO2 + O2
Меры предосторожности, которые необходимо соблюдать при обращении с нитратом бария
Высокие концентрации этого соединения могут быть чрезвычайно ядовитыми для человека.
Необходимо соблюдать осторожность, чтобы не вдыхать слишком много его паров.
Аналогичным образом, прямое попадание в глаза и на кожу также может привести к ряду вредных симптомов.
Раздражение верхних отделов легких, кожи и глаз — вот некоторые из признаков отравления нитратом бария.
Примечательно, что их можно легко избежать, принимая простые меры предосторожности при обращении с ним.
Применение нитрата бария
В фейерверках
Нитрат бария является ценным соединением, когда речь заходит о производстве фейерверков, поскольку он может помочь в производстве зеленого пламени.
Помимо простых фейерверков, это соединение также используется в нескольких пиротехнических представлениях.
Точно так же, как нитрат бария вызывает зеленое пламя; хлорид натрия приводит к образованию желтого пламени, в то время как хлорид меди при горении становится синим.
В стекольной промышленности
Нитрат бария является важнейшим продуктом при создании высококачественных изделий из стекла.
Молекула кислорода, присоединенная к этому соединению, может помочь сохранить стеклянные изделия от обесцвечивания.
Кроме того, такая стеклянная посуда исключительно прозрачна. Специалисты также используют это соединение при производстве оптических стекол.
Нитрат бария в объективах фотоаппаратов может улучшить показатель преломления, что приводит к более четким снимкам.
Военном деле
Нитрат бария помогает в производстве трассирующих пуль. При выстреле можно точно следовать маршруту полета пули благодаря заряду Ba(NO3)2, размещенному прямо на конце такого боеприпаса.
Этот заряд загорается при выстреле такими пулями из пистолета. Виден дым от этой части, точно указывающий траекторию полета пули.
Кроме того, нитрат бария является одним из основных соединений при создании сигнальных ракет, используемых для подачи сигнала войскам о прибытии в определенное место.
Родентицид
Это соединение также является надежным родентицидом. Оставляя его на открытом воздухе в вашем доме, вы предотвратите проникновение различных грызунов, таких как мыши и крысы, или пребывание внутри помещения.
Краски
Краски на стенах вашего дома — это просто смесь различных химических соединений. Нитрат бария — лишь одно из таких соединений.
Примечательно, что большинство красок не существовало бы без этого специфического нитрата бария, поскольку он часто используется в качестве основного компонента.
Часто задаваемые вопросы и ответы?
В лаборатории получение нитрата бария является взаимодействие гидроксида бария с азотной кислотой, на производстве также используют вторичный метод реакцией между сульфидом бария и азотной кислотой.
В стекольной промышленности, в фейерверках, военном деле.
Является солью сильного основания и сильной кислоты и не гидролизуется, среда нейтральная.