Выщелачивание цинка Выщелачивание огарка

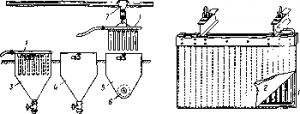
Рис. Схема непрерывного, двустадийного выщелачивания огарка
Огарок выщелачивают горячим или после охлаждения, применяя оборотные растворы — смесь отработанного электролита и промывных вод (20—60 г/л H2SO4 и до 100 г/л Zn). Активная концентрация кислоты при этом ниже аналитической, коэффициент активности Н+ в смешанных растворах неизвестен, а большая ионная сила затрудняет его вычисление. В табл. приведены ан+, определенные Н. Н. Севрюковым опытным путем на потенциометре со стеклянным электродом для синтетических химически чистых растворов.
Т а б л и ц а . Состав раствора
| Zn | H2SО4 | рН | ан+ | fн+ | ||
| г/л | г-ион/л | г/л | моль/л | |||
| 132 90,8 90,8 90,8 | 2,02 1,39 1,39 1,39 | 19,6 39,2 58,8 | 0,2 0,4 0,6 | 4,37 0,78 0,60 0,16 | 2,3•10—4 0,17 0,25 0,69 | 0,42 0,31 0,12 |
В табл. 2 приведены расчеты констант равновесия предполагаемых реакций и равновесных активностей ионов. Из полученных цифр видна возможность выщелачивания ZnO, Zn3(AsO4)2, ZnSiO4, но не ZnSiO3 и ZnS. Железо может переходить в раствор из всех соединений, включая Fe(OH)3, но не из Fe2O3. Окислы меди (II) и кадмия полностью растворяются, Сu2О — частично, а сульфиды — ограниченно. Главным источником Н2SiO3, по-видимому, служит PbSiO3.
Таблица 2. Реакции, предполагаемые при выщелачивании обожженного цинкового концентрата
| Реакция | Способ расчета К | К |
| ZnO + 2Н+ == Zn2+ + Н2O | (4) | 1,6•1011 |
| ZnS + 2Н+ = Zn2+ + H2S | (122) | 1,3• 10—4 |
| ZnSiO3 + 2H+ = Zn2+ + H2SiO3 | (4) | 1,3•10-2 |
| Zn2SiO4+ 4H+ = 2Zn2+ + H2SiO3 + H2O | (4) | 5•104 |
| Zn3 (AsO4)2+ 6H+ = 3Zn2+ + 2H3AsO4 | (122) | 3,2•1014 |
| ZnFe2O4 + 8H+ = Zn2+ + 2Fe3+ + 4H2O | (4) | 1•105 |
| Fe2O3 + 6H+ = 2Fe3+ + 3H2O | (4) | 4•10-4 |
| Fe(ОН)3 + 3H+ = Fe3+ + 3H2O | (122) | 3,2•104 |
| Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O | (4) | 104 |
| Fe2SiO4 + 4H+ = 2Fe2+ + H2SiO3 + H2O | (4) | 7,8•106 |
| FeAsO4 + 3H+ = Fe3+ + H3AsO4 | (122) | 3,1 |
| PbSiO3 + 4H+ + SO24— = PbSO4 + H2SiO3 + н2о | (122) | 2,5•1057 |
| Pb3(AsO4)2 + 6H+ + 3SO24— = 3PbSO4 + 2H3 AsO4 | (122) | 3•1029 |
| PbS + 2H+ + SO24— = PbSO4+ H2S | (122) | 12,0 |
| CuO+2H* = Cu2+ + H2O | (4) | 2,5•107 |
| Сu2O + 2H+ = Cu2+ + Cu + H2O | (4) | 4,6•103 |
| In2O3 + 6H+ = 2In3+ + 3H2O | (4) | 3,2•1012 |
| T12O + 2H+ = 2Tl+ + H2O | (4) | 2•109 |
| Ga2O3 + 6H+ = 2Ga3+ + 3H2O | (4) | 3•104 |
| Cd3 (AsO4)2 + 6H+ = 3Cd2+ + 2H3AsO4 | (4) | 2,9•1012 |
| CdS + 2H+ = Cd2+ + H2S | 022) | 6•10-7 |
| CdO + 2H+ = Cd2+ + H2O | (4) | 1 • 1015 |
Скорости растворения окислов железа и ферритов, изученные разными авторами при концентрациях H2SO4 более 50 г/л и в отсутствие сульфата цинка, не могут найти четкого приложения к оценке поведения огарка при обычном режиме выщелачивания. Применение некоторыми заводами сильно кислых горячих растворов (250 г/л H2SO4 при 90° С) показывает возможность выщелачивания ферритного цинка и окислов железа (III). По опытным данным, в конце выщелачивания рH=5,34÷5,5. Из последней цифры вычислены вероятные остаточные активности примесей (табл. 3); приравнять их к концентрациям можно лишь условно. Железо (III) практически полностью гидролизуется, железо (II) остается в растворе, поэтому его окисляют добавкой МnO2;
2Fe2+ + MnO2 + 4Н+ = 2Fe3+ + 2Н2О + Мn2+;
Реакция состоит из двух окислительно-восстановительных систем: МnO2 + 4Н+ + 2е = Мn2+ + 2Н2O, E0 = 1,23 В, 2Fe2+ — 2e = 2Fe3+ , E0 = 0,77В,
Среднее содержание Мn2+ в циркулирующих растворах около 0,1 моль/л. Подставляя эту цифру в выражение для и выражая необходимую пол—
Таблица 3 . Гидролиз ионов примесей в растворе сульфата цинка при рН = 5,5
| Предполагаемая реакция | pK | К | Равновесная активность Men+ | |
| г-ион/л | мг/л | |||
| Fe3+ + 3H20 = Fe(OH)3 +
+ 3Н+ |
4,5 | 3,2•10-5 | 10-9 | 5,6•10-5 |
| Fe2+ + 2Н2O = Fe(OH)2 + + 2Н+ | 13,0 | 1•10-13 | — | Не гидролизуется |
| Cd2+ + 2Н2O = Cd(OH)2 + +2 Н+ | 14,2 | 6,3•10-15 | — | То же |
| Cu2+ + 2Н2O = Cu(OH)2 + + 2Н+ | 8,3 | 5•10-9 | 2,2•10-3 | 140 |
| In3+-f 3H2O = In(OH)3 + + 3Н+ | 8,7 | 2•10-9 | 1,6•10-5 | 1,84 |
| Ga3+ + 3H2O = Ga(OH)3 +
+3 н+ |
6,8 | 1,6•10-7 | 5•10-7 | 3•10-2 |
| FeAsO4 + 3H2O = Fe(OH)8+ + H3AsO4 | 4,0 | 10-4 | 10-4
(AsO34—) |
7,5(As) |
ноту окисления железа отношением aFe3+/aFe2+ =103 .получим рН= 1,3. Из этого следует, что МnО2 надо добавлять, когда кислотность раствора еще достаточно велика.
К концу выщелачивания рН достигает 5,2—5,5. Примеси гидролизуются и железо (III) выпадает в осадок в виде основных солей и Fe(OH)3 (см. табл. 3).
Практически получаемые результаты очистки показаны ниже, в нейтральном растворе остается:
Примеси …. Fe3+ Fe2+ As Sb Концентрация:
мг/л …. 2—10 40 0,3—0,6 0,2—0,3
моль/л (средн.) 9•10-4 8•10-3 5,2•10—5 2•10-6
Продолжение
Примеси …. Ge Сu SiO2
Концентрация:
мг/л….. 0,1 5000—1000 200—300
моль/л (средн.) 1,4•10-5 1,2-10-2
Различие расчетных и практических данных прежде всего обусловлено выражением первых в активностях, а вторых — в концентрациях. Необходимые для точного сопоставления цифр коэффициенты активности нельзя рассчитать из-за высокой ионной силы растворов. Некоторое значение имеет также трудность достижения равновесия гидролиза и весьма большое — сорбция осадком, особенно соединений мышьяка, сурьмы, индия, германия и теллура.
Кремниевая кислота, выделяемая при разложении силикатов, трудно растворима, но дает коллоидные системы лиофильного типа, коагулирующие при вытеснении воды с поверхности мицелл ионами водорода. По А. Д. Маянц, начало коагуляции Н2SiO3•мН2О зависит от ее концентрации и кислотности:
SiO2, г/л … . 12 8 2,25 1,5
рН …. 3,5 4,1 4,7 5,0
Студнеобразный гель кремниевой кислоты затрудняет сгущение и фильтрацию пульп.
Скорость выщелачивания изучали многие исследователи. По данным А. Н. Вольского и Е. М. Сергиевской, переход в раствор цинка из окиси в пределах снижения концентрации Н2SО4 до 0,36 моль/л контролируется диффузией, а далее химической кинетикой. Ферриты цинка, образуемые при обжиге, условно записывают формулой ZnO • Fe2О3 или ZnFe2О4, хотя состав их может быть и более сложным. По данным тех же авторов , цинк из феррита простого состава выщелачивается значительно медленнее, чем из окиси и при кинетическом контроле во всём интервале снижения кислотности.
В итоге получается, что первая нейтрализация кислоты происходит за счет легкорастворимой ZnO, а на долю упорных ферритов H2SО4 остается в сравнительно малой концентрации, по соображением подтверждается невозможность растворения при обычном режиме выщелачивания огарка Fe2О3, Fe2O3, ZnS и ZnFe2О4.
Температура при выщелачивании повышается за счет тепла, вносимого горячим огарком, если же он предварительно охлажден, тогда только за счет экзотермических, реакций. Подогрев растворов паром дорог: объемы их обычно велики и большие затраты энергии часто не оправдываются повышением извлечения. Обычная температура 50—60, подогрев до 80—90° С применяют редко.
Практика выщелачивания различна в зависимости от состава сырья, его постоянства и масштабов производства. Если концентраты поступают от разных поставщиков, удобнее периодическое выщелачивание, режим которого легко менять, но труднее механизировать и автоматизировать. При работе на концентратах постоянного состава лучше пользоваться более производительным непрерывным способом.
Периодическое выщелачивание проводят в механических пропеллерных мешалках с диффузором, иногда при подогреве пульпы паровыми змеевиками. Огарок после обжига охлаждают, выделяют из пего грохочением мелкую часть (—0,15 мм), а крупную — доизмельчают. Пыль циклонную всегда присоединяют к огарку, а собираемую в электрофильтрах — в зависимости от состава. После загрузки твердого заливают рассчитанное количество раствора повышенной кислотности (60 г/л H2SO4) и перемешивают 1,5—2 ч. Остаток кислоты (~5 г/л) нейтрализуют до рН—5,5 малыми добавками огарка или пыли. Дальнейшие переделы сходны с описанными ниже для непрерывного выщелачивания.
Непрерывное выщелачивание в трех — четырех последовательно действующих пневматических мешалках разделяется на нейтральное и кислое, для каждого из них устанавливают отдельные подобные цепи аппаратов, движение материалов.
Каждая цепь из трех — четырех пневматических мешалок завершается сгустителями и фильтрами.
Нейтральная пульпа разделяется в нейтральных сгустителях на слив (ВСНС) и сгущенный продукт (НСНС). Первый для осветления пропускают через фильтрпрессы и направляют на очистку, а затем на электролиз; второй — подают на кислое выщелачивание.
Кислой пульпе после выщелачивания дают отстояться в кислых сгустителях. ВСКС, в котором остается около 5 г/л H2SО4, направляют на нейтральное выщелачивание, предварительно окислив железо, а сгущенный продукт (НСКС) фильтруют, peпульпируют промывной водой, снова фильтруют, сушат и выводят нерастворимый остаток —цинковый кек на отдельную переработку.
Перед непрерывным выщелачиванием огарок не классифицируют, а прямо из обжиговой печи выпускают в желоб и смывают струей ВСКС в конусные классификаторы для выделения песков— частиц крупнее 0,15 мм.
Классификатор —конус из нержавеющей стали, обращенный вершиной вниз. По периметру его открытого основания проходит кольцевой желоб, в который уносятся сливом мелкие частицы, а пески оседают и периодически выгружаются через отверстие у вершины.
Пески, выход которых не более 10% от массы огарка, выщелачивают отдельно и пульпу снова классифицируют в устроенных также кислых классификаторах, слив которых поступает на кислое выщелачивание огарка, а вторичные пески смешиваются с отвальным цинковым кеком.
Рис. 2. Рамный (листовой) вакуум-фильтр:
1 — рама, согнутая из трубы; 2 — фильтровальная ткань; 3 — чан для фильтрации; 4 —чан для промывки кека; 5 — чан для сбрасывания и выгрузки кека; 6 — шнек; 7 — тельфер
Цинковый кек перед выводом из производства необходимо отделить от раствора и хорошо промыть: около половины его массы составляет богатый цинком раствор. При этом нельзя тратить много воды, иначе промывных растворов получится больше, чем можно использовать при выщелачивании. Для хорошей промывки сравнительно малыми количествами воды удобны рамные фильтры периодического действия.
Фильтр состоит из 10—30 рам, подвешенных параллельно на двутавровых балках (рис. 2). Остов каждой из них согнут из, медной трубы, на части ее, обращенной внутрь рамы, сделаны отверстия; один конец заглушен, а другой подключен через коллектор к вакуум-насосу. В раму закладывают деревянные планки и обтягивают ее фильтровальной тканью. Мостовым краном комплект рам погружают в чан с пульпой. Под действием вакуум-насоса раствор, просачивающийся через поры ткани, отводят через коллектор в ресивер, а на ткани откладывается слой кека толщиной 30—40 мм. Затем фильтр переносят краном в чан с водой, а в коллектор подают сжатый воздух, отдувающий и сбрасывающий кек. После перемешивания (репульпации) пульпу вторично фультруют на барабанных или дисковых вакуумфильтрах.
Производительность рамного фильтра от 0,3 до 1 т влажного кека на 1 м2 поверхности ткани, общая площадь которой достигает 1000 м2.
Статья на тему Выщелачивание цинка

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.