Восстановление окислов сульфидами
MeS + 2MeO= 3Ме + SO2,
MeS + O2 = Me + SO2.
Если все участники реакций при данной температуре в твердом стоянии и взаимно нерастворимы, а давления паров их постоянны, то
K = pSO2
Для примера рассчитаем константу равновесия при 1000° С реакции:
Cu2S + 2Cu2О = 6Cu + SО2;
ΔZ0 = ΔZ0SO2 — ΔZ0Cu2S — 2ΔZ0Cu2O
Находим:
ΔZ0S1000°C = — 265 — (—95) — (—160) = —10кДж;
lg.K = 10000 : (19,1 • 1273) = 0,41; K = pSO2 ≈ 263445 Па
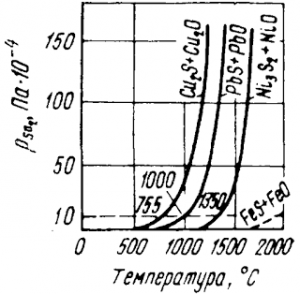
Результаты подобных расчетов для других металлов показаны на рис.
В случаях плавления или взаимного растворения участников реакции в выражение для К должны войти их активности в сплавах.
Рис. Условия взаимодействия сульфида и окисла одного металла (по А. Н. Вольскому и Е. М. Сергиевской)
Помимо того, сульфиды и окислы разных металлов в расплавах могут обмениваться кислородом и серой, например реакция, имеющая первостепенное значение для пирометаллургии меди, где требуется отделить медь от железа:
Cu2О + FeS = Cu2S + FeO.
У железа разность сродства к кислороду и сере больше, чем у меди, которой оно отдает свою серу в обмен на кислород. В присутствии кварца FeO связывается в силикат и переходит в шлак, a Cu2S с остатком сульфида железа — в штейн. Последний в застывшем состоянии похож на камень — по-немецки Stein. Жидкие сплавы силикатов и сульфидов взаимно нерастворимы, по плотности они различны и образуют два несмешивающихся жидких слоя подобно металлам и шлакам. Если часть серы предварительно окислить и оставить ее только в количестве, необходимом для связывания меди, все железо перейдет в шлак, а в штейне останется почти чистая Cu2S, которую можно частично окислить и превратить в медь по реакции.
Статья на тему Восстановление окислов сульфидами

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.