ВЛИЯНИЕ СОЛЕВЫХ ДОБАВОК ЭЛЕКТРОЛИЗА АЛЮМИНИЯ
Помимо основных компонентов электролита — криолита, фтористого алюминия и глинозема, в расплав специально вводят другие соли. Эти добавки изменяют физико-химические свойства электролита и приводят к улучшению показателей процесса электролиза.
Прежде чем рассматривать влияние каждой соли, выясним, какой эффект можно вообще ожидать от введения посторонних добавок в электролит.
Применяемые соли должны иметь катионы более электроотрицательные, чем Аl3+, а анионы более электроположительные, чем О2-. В противном случае будет происходить восстановление катионов добавок на катоде с загрязнением алюминия и окисление анионов на аноде с получением нежелательных продуктов в анодных газах. Другими словами, добавки должны быть в электрохимическом отношении индифферентными.
Первое, что ожидается от введения добавки — понижение температуры ликвидуса электролита. Действительно, введение другой соли дает более сложные системы, обычно эвтектического типа, что и приводит к понижению температуры начала кристаллизации. Необходимо, однако, иметь в виду, что понижение температуры плавления электролита не может автоматически привести к снижению рабочей температуры электролиза (со всеми вытекающими отсюда благоприятными последствиями).
Работающий электролизер находится в энергетическом равновесии с окружающей средой: сколько энергии выделяется внутри электролизера, столько расходуется на осуществление реакции и на компенсацию потерь энергии в окружающее пространство. Если в результате введения добавки произошло понижение температуры плавления электролита, то температура электролиза может снизиться только в том случае, если повысятся потери энергии в окружающее пространство. Опыт показывает, что обычно так и происходит: понижение температуры плавления приводит к уменьшению толщины гарниссажей из застывшего электролита на боковой поверхности футеровки, а также толщины корки электролита сверху ванны, отчего увеличиваются потери энергии.
Нарушенное энергетическое равновесие электролизера за счет введения добавок может быть восстановлено путем повышения плотности тока, что приводит к увеличению выделений энергии внутри электролизера до тех пор, пока не будут скомпенсированы увеличенные потери энергии. Этот путь приводит к повышению производительности электролизеров.
Из других физико-химических свойств электролита, изменяющихся при введении добавок, отметим прежде всего электропроводимость. Повышение ее приводит при прочих равных условиях к увеличению производительности электролизеров либо за счет увеличения плотности тока при неизменном междуполюсном расстоянии, либо за счет повышения выхода по току, вызванного увеличением междуполюсного расстояния. Первый путь более эффективен.
Понижение вязкости электролита желательно для увеличения циркуляции и улучшения теплообмена и переноса растворенного глинозема между периферией и центром электролизера. С другой стороны, усиление циркуляции электролита приводит к повышению потерь металла.
Повышение плотности электролита нежелательно, поскольку уменьшается разность плотностей между электролитом и металлом, что способствует перекосу поверхности металла и увеличению высоты волн на этой поверхности. Большинство добавляемых солей имеют давление насыщенного пара значительно ниже, чем основные составляющие электролита — криолит и фтористый алюминий, что способствует снижению общего давления пара и уменьшению потерь солей с возгонами.
Добавляемые соли уменьшают активность NaF и AlF3, вследствие чего взаимодействие алюминия с электролитом ослабляется и потери металла по реакциям (25) и (26) уменьшаются, а выход по току повышается. Вместе с тем разбавление электролита индифферентной солью приводит к уменьшению активности комплексов AlF36—, которые являются «растворителями» глинозема.
Поэтому солевые добавки понижают растворимость глинозема, что вызывает ряд технологических затруднений: рост осадков и настылей на подине электролизеров, нарушение нормального питания глиноземом. Только введение в электролит фторидов калия могло бы привести к повышению растворимости глинозема, но соли калия никогда не вводят по той причине, что калий, восстанавливаясь на катоде, проникает в угольную футеровку и легко ее разрушает.
При выборе добавок большое внимание обращают на стоимость и доступность соли, а также на ее физические свойства, такие как гигроскопичность, склонность к гидролизу, токсичность.
В табл. 4 приведены физико-химические свойства криолитовых расплавов с добавками 10% (по массе) различных солей.
Рассмотрим теперь более подробно влияние каждой из добавляемой соли на процесс электролиза.
Фторид кальция
Обычно специально в электролит не вводят, поскольку эта соль присутствует как примесь в криолите и фториде алюминия. Диаграмма плавкости системы Na3AlF6—CaF2 эвтектического типа, с температурой эвтектики 945 °С при 50% (мол.) CaF2 (Холм). Фторид кальция понижает температуру плавления меньше, чем другие солевые добавки. Он повышает плотность и вязкость и понижает электропроводимость, что нежелательно. Фтористый кальций способствует созданию устойчивых гарниссажей и настылей и повышает выход по току.
Фторид магния
По многим свойствам более эффективная добавка, чем фторид кальция. Понижает температуру плавления значительно больше, чем другие добавки. В системе NaF—MgF2 имеется химическое соединение NaMgF3(Костюков, Смородинов), поэтому система Na3AlF6—MgF2 является нестабильным диагональным сечением взаимной тройной системы: Na3AlF6 + 3MgF2 ⇄AlF3 + 3NaMgF3.
По некоторым данным, в системе NaF—MgF2 имеется еще одно соединение—Na2MgAlF7, что в значительной степени усложняет диаграмму состояния.
Добавка фтористого магния ухудшает смачивание расплавом угольных частиц и способствует полному отделению угольной «пены». Обычно в электролит вводят оксид магния, при этом фторид магния получается
| Таблица 4. Физико-химические свойства расплавленного криолита с добавками 10% (по массе) солей при 1000 °С | |||||
| Соль | Понижение
температуры плав- ления, °С |
Плотность, г/см3 | Удельная электропроводи-
мость, См/м |
Вязкость, мПа-с | Потери алюминия на 100 г расплава, г/ч |
| Без добавок LiF
MgF2
CaF2NaCl MgCl2 |
—
80 59 25 44 92 |
2,100
2,060 2,106 2,162 2,010 2,020 |
270
340 255 265 308 237 |
2,75
1,63 Нет св. 2,88 2,40 1,50 |
1,20
1,20 0,75 0,95 1,30 1,05 |
в результате реакции обмена 3MgO + 2Na3AlF6⇄3MgF2 + А12О3 + 6NaF.
Суммарное содержание фторидов кальция и магния обычно не превышает 6—8% (по массе).
Фторид лития
При взаимодействии с натриевым криолитом образует литиевый криолит Na3AlF6 + 3LiF ⇄ Li3AlF6 + 3NaF, температура плавления которого 800 °С. В литиевом криолите растворимость глинозема приблизительно в 4 раза меньше, чем в натриевом. Поэтому добавки LiF в электролит приводят к резкому снижению растворимости Al2O3. Главное свойство добавок литиевых солей — сильное увеличение электропроводимости электролита, что связано с малым, по сравнению с ионом Na+ радиусом иона Li+. Поэтому добавки солей лития позволяют значительно-интенсифицировать процесс электролиза. Основное препятствие для использования солей лития в качестве добавок — высокая их стоимость и дефицитность.
Хлорид натрия
Увеличивает электропроводимость электролита и существенно снижает температуру плавления. Реакция обменного разложения 3NaCl + Na3AlF6⇄ 6NaF+AlCl3 практически не происходит, поскольку для нее ΔG0=+318 кДж/моль криолита. Испытания добавок хлорида натрия показали, что происходят потери ионов Сl— из электролита, что связано с испарением NaCl.
Взаимодействие этих паров с медными, анодными спусками (в электролизерах БТ) приводит к значительной их коррозии. Другой существенный недостаток добавки NaCl — упрочнение электролитной корки, по-видимому, вследствие поглощения паров NaCl. Вместе с тем, как указано выше, добавки иона Cl— в электролит приводят к заметному снижению расхода углерода. Для нивелирования упомянутых недостатков; добавки NaCl эту соль вводят в электролит только в комбинации с другими добавками.
Хлорид магния
Существенно понижает температуру плавления и вязкость электролита. Однако применение-его затруднено из-за склонности соли к гидролизу, при котором вместе с добавкой MgCl2 вносится в электролит значительное количество влаги, что недопустимо с позиций техники безопасности.
На некоторых заводах применяют совместные добавки NaCl и MgF2, при этом происходит повышение-электропроводимости электролита за счет введения катионов Na+ и заметное снижение расхода углерода,
Эти величины давлений получены при условии, когда pHF + pH2O = 101,3 кПа.
Глинозем, поступающий в электролит, обычно прокаливается на корке, и основная масса воды удаляется, поэтому потери фторида алюминия относительно невелики: если считать, что в глиноземе останется 0,1% (по массе) воды, то на 1 т алюминия за счет реакции гидролиза будет затрачиваться всего 1,8 кг фтористого алюминия.
Источниками влаги являются также водород и углеводороды, образующиеся при коксовании анодной массы. Вода образуется по реакции Н2 + СO2 = Н2O + СО Если допустить, что вся эта влага реагирует с фтористым алюминием, то потери его составят уже 19 кг на 1 т алюминия. На самом деле часть воды растворяется в электролите и подвергается электролитическому разложению с выделением на катоде водорода, который растворяется в алюминии. При литье алюминиевых, слитков водород вследствие понижения его растворимости выделяется в виде пузырьков, и качество отливок ухудшается. Для электролизеров с обожженными анодами этот источник влаги отсутствует.
Оксиды щелочных и щелочно-земельных металлов
Поступают в электролит в основном с глиноземом. Вредное влияние их на процесс связано прежде всего с изменением состава электролита за счет реакции обмена 2Na3AlF6 + 3Na2O ⇄ 12NaF + Al2O3. В результате концентрация фторида алюминия падает и криолитовое отношение возрастает. Для корректировки состава электролита приходится вводить дорогой фторид алюминия.
Равновесное содержание натрия в алюминии составляет тысячные доли процента и повышается с возрастанием криолитового отношения и температуры. В промышленных условиях также отмечается, что повышение криолитового отношения с 2,5 до 3 вызывает увеличение содержания натрия от 0,005 до 0,014% (по массе). Между тем при производстве некоторых деформируемых сплавов на основе алюминия примесь натрия в таких концентрациях является недопустимой и приходится принимать специальные меры для его удаления.
Оксиды металлов, более электроположительных, чем алюминий
(SiO2, TiO2, Fe2O3, V2O5, Cr2O3 и др.), попадают в электролит из исходных материалов или футеровки электролизеров. В электролите они хорошо растворимы и подвергаются электролитическому разложению, причем на катоде выделяется металл, загрязняющий алюминий. Часть оксидов кремния, титана, ванадия и хрома взаимодействует с криолитом по реакциям типа 3SiO2+4Na3AlF6 ⇄ 3SiF4 +12NaF+2Al2O3.
Хотя термодинамические расчеты показывают, что константы равновесия этих реакций малы (за исключением SiO2), но получающиеся продукты — фториды соответствующих металлов обладают большим давлением пара и уносятся анодными газами. Поэтому такие реакции играют существенную роль в удалении соответствующих примесей из электролита.
На промышленных электролизерах показано (Се-нин), что 20—37% соединений ванадия, титана и хрома удаляются через системы газоулавливания.
Примеси титана, ванадия, хрома и марганца сильно снижают электропроводимость алюминия и поэтому особенно нежелательны для металла, идущего на производство проводов. Для очистки алюминия от этих примесей применяется добавка бора. Соединения бора — буру или борную кислоту вводят в электролит, где они разлагаются электролитически, а выделяющийся бор соединяется с указанными металлами, давая интерме-таллиды. При этом концентрация примесей металлов в-алюминии существенно понижается.
Повышение содержания бора до 0,017%) приводит к снижению концентрации ванадия и титана в 5—6 раз (Сенин). Кроме того, введение бора в алюминий него сплавы способствуют модификации — получению мелкокристаллической структуры, что улучшает пластические свойства металла.
Сульфаты и сульфиды
Поступают в электролит с глиноземом, фторсолями (сульфаты) и с анодной массой (сульфиды). Сульфаты вступают в обменную реакцию с криолитом 3Na2SO4 + 2Na3AlF6 ⇄ Al2(SO4)3+12NaF, в результате которой повышается криолитовое отношение электролита. Растворенный в электролите сульфат восстанавливается алюминием 3Na2SO4 + 8Al ⇄ 3Na2S + 4А12O3, а получающийся сульфид переносится к аноду и окисляется: S2-—2e = S; S + 2CO2 = SO2 + 2CO. Выделяющийся сернистый газ ухудшает условия труда в цехе.
Наличие заметных количеств серы в анодной массе нежелательно, поскольку на стальных штырях образуется корка плохо проводящего ток сульфида железа FeS, что повышает падение напряжения в аноде.
Фосфорный ангидрид Р2О5
Поступает в электролит с глиноземом и фторсолями. Фосфор является вреднейшей примесью в алюминии, так как вызывает его красноломкость. Кроме того, с повышением содержания фосфора до 0,002% (по массе) заметно уменьшается коррозионная стойкость алюминия и сплавов на его основе.
Присутствие соединений фосфора в электролите приводит к улучшению смачивания электролитом угольной «пены». Взвесь углерода плохо отделяется от электролита, электросопротивление его увеличивается, электролизер перегревается и процесс электролиза нарушается.
При электролизе фосфор удаляется главным образом в виде летучих соединений (с газами) и с угольной «пеной». При флотации «пены» фосфор уходит в хвосты и не возвращается в электролит.
Статья на тему Влияние солевых добавок электролиза алюминия


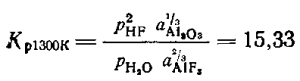
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.