ЭЛЕКТРОЛИТ АЛЮМИНИЯ
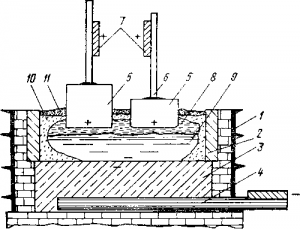
На стенках рабочего пространства ванны электролит образует настыли, а на открытой поверхности расплава — твердую корку 10. На корку насыпают глинозем 11 по мере его расходования.
Многочисленные попытки заменить расплавленный криолит каким-либо другим веществом для осуществления электролиза глинозема пока не увенчались успехом.
Однако криолит дорог, плавится при высокой температуре и в расплавленном состоянии обладает значительной летучестью.
Рис. Принципиальная схема электролиза для получения алюминия
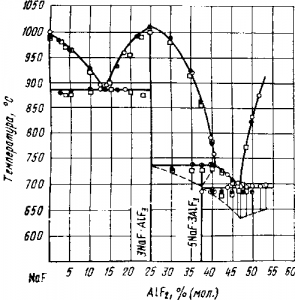
На рис. 2 приведена диаграмма плавкости системы, построенная еще в двадцатых годах П. П. Федотьевым и В. П. Ильинским и подтвержденная более поздними исследованиями многих ученых. На диаграмме четко выделяется максимум при 25% (мол.) AlF3, что соответствует составу криолита. Температура плавления криолита 1000° С.
Рис. 2. Диаграмма плавкости системы фтористый натрий — фтористый алюминий (по п. п. Федотьеву и В. П. Ильинскому);
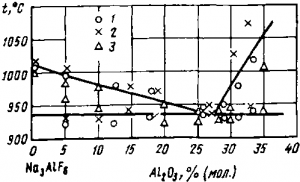
Молярное отношение NaF/AlF3 в электролите называется криолитовым отношением. Для чистого криолита оно равно 3. Заводы работают с так называемыми «кислыми» электролитами, имеющими криолитовое отношение 2,8—2,5. Чрезмерно кислые электролиты летучи и хуже растворяют глинозем. Электролиты с криолитовым отношением свыше 3 негодны к применению, так как при повышении концентрации ионов натрия начинается заметное выделение натрия на катоде. При растворении в криолите от 10 до 16% (мол.) глинозема температура плавления системы заметно снижается, что хорошо иллюстрируется диаграммой плавкости Na3AlF6—Al2O3. Эта диаграмма изучалась многими исследователями, однако их данные имеют большие расхождения. По-видимому, наиболее достоверны данные Г. А. Абрамова и А. А. Костюкова. На рис.3 приведена опубликованная ими в 1953 г. диаграмма. Большой теоретический и практический интерес представляет изученная Ґ. А. Абрамовым и А. А. Костюковым тройная диаграмма
Рис. 3. Диаграмма состояния системы криолит — глинозем, по данным Г. А. Абрамова и А. А. Костюкова (1), 3. Ф. Лундиной (2) и П. П. Федотьева и В. П. Ильинского (3)
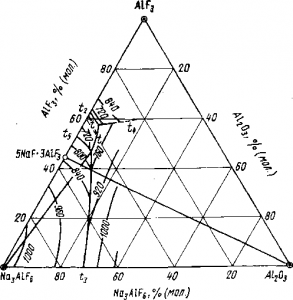
Na3AlF6—AlF3—Аl2O3 (рис. 4). При введении в расплав глинозема свыше 15% (по массе) температура плавления электролита резко повышается. В расплавленном криолите при 1000° С удается с большим трудом растворить 12% глинозема, поэтому практически в электролите концентрация глинозема редко превышает 8% (по массе).
На ряде отечественных и зарубежных заводов в состав электролита вводят добавки других фтористых солей. Наиболее широко для этого применяют фтористый кальций (СаF2), который несколько снижает температуру плавления электролита.
Снижение температуры плавления электролита положительно сказывается на электролизе, однако добавка CaF2приводит к уменьшению скорости растворения глинозема в расплавленном криолите и некоторому снижению его электропроводности, что нежелательно. А. И. Беляев с сотрудниками, изучая электролиз глинозема, пришел к выводу о целесообразности введения в электролит добавки MgF2 вместо CaF2, так как фтористый магний снижает температуру плавления электролита больше, чем CaF2 и уменьшает плотность электролита. Некоторые заводы добавляют в электролит немного хлористого натрия для повышения его электропроводности. Но указанные добавки снижают растворимость глинозема в электролите и поэтому их вводят в очень небольших количествах (6—8%).
Рис. 4. Диаграмма системы криолит — фтористый алюминий — глинозем (по данным Г. А. Абрамова и А. А. Костюкова)
Плотность металлического алюминия при 18° С равна 2,7 г/см3, чистый криолит при этой температуре тяжелее алюминия; его плотность равна 2,95 г/см3. Однако при температурах электролиза расплавленный алюминий оказывается тяжелее криолита, особенно если в последнем растворено заметное количество глинозема; так, например, при 950° С плотность алюминия равна 2,3 г/см3, в то время как плотность криолита, содержащего 5% глинозема, при этой же температуре будет соответственно равна 2,1 г/см3. Вследствие этой разницы полученный на катоде алюминий при температурах 900—1000° С не будет всплывать и останется на дне ванны. При сильном охлаждении ванны или изменении состава электролита иногда наблюдаются случаи «всплывания» алюминия.
Важным фактором, характеризующим электролит, является его электропроводность. Удельное сопротивление электрод (криолит +10% глинозема при 1000° С), по данным К. И. Баташева, равно 0,37 Ом • см. Измерения удельного сопротивления электролита в промышленных ваннах дают более высокие цифры, по-видимому, потому что в электролите всегда присутствуют примеси угля, карбидов и других веществ. Поэтому для технических расчетов принимают удельное сопротивление электролита, равное 0,5—0,55 Ом•см. Тепло, выделенное при прохождении электрического тока через слой электролита между анодом и катодом, обеспечивает в больших промышленных ваннах сохранение нормальной температуры процесса (950°С).
Статья на тему Электролит алюминия

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.