Свинцовый аккумулятор
На окислительных свойствах четырехвалентного свинца и его переходе в более устойчивое двухвалентное состояние основано устройство и действие широко применяемых на практике свинцовых аккумуляторов.
Электрическими аккумуляторами называются приборы, позволяющие накапливать электрическую энергию с тем, чтобы потом расходовать ее в нужный момент. Это накопление энергии осуществляется путем пропускания через аккумулятор электрического тока, в силу чего в нем происходит химический процесс, сопровождающийся превращением электрической энергии в химическую; аккумулятор, как говорят, заряжается. Заряженным аккумулятором можно пользоваться как гальваническим элементом, причем та же самая реакция, которая происходила при зарядке аккумулятора, протекает в обратном направлении и накопленная в аккумуляторе химическая энергия превращается в электрическую; по мере ее расходования аккумулятор разряжается.
Свинцовый аккумулятор составляется в простейшем случае из двух решетчатых свинцовых пластин, ячейки которых заполняются тестообразной смесью окиси свинца с водой. Пластины погружаются в прямоугольную стеклянную банку, наполненную разбавленной серной кислотой уд. веса 1,15—1,20 (22—28% H2SO4).
Вследствие реакции
РbО + H2SO4 = PbSO4 + Н2O
окись свинца превращается через некоторое время в сернокислый свинец. Если теперь пропускать через прибор постоянный ток, соединив одну пластину с отрицательным, а другую — с положительным полюсом источника тока, то аккумулятор будет заряжаться, причем у электродов будут происходить следующие процессы:
Складывая эти уравнения, получаем общее уравнение реакции, происходящей при зарядке аккумулятора:
2PbSO4 + 2Н2O = Pb + РbO2 + 4Н• + 2SO4»
Таким образом, по мере пропускания тока сернокислый свинец превращается на катоде в рыхлую массу металлического свинца, а на аноде — в темнобурую двуокись свинца.
Когда этот процесс закончится, — аккумулятор заряжен. Об окончании зарядки свидетельствует начало энергичного разложения воды: у катода выделяется водород, у анода— кислород (аккумулятор «кипит»).
При соединении пластин заряженного аккумулятора проводником в последнем появляется ток, причем электроны перемещаются от пластины, покрытой свинцом, к пластине, покрытой двуокисью свинца. Возникновение тока объясняется следующим образом. С пластины, покрытой свинцом, часть ионов Рb++ переходит в раствор, вследствие чего пластина заряжается отрицательно. Освобождающиеся у свинцовой пластины электроны переходят к РbO2 и восстанавливают четырехвалентный свинец в двухвалентный. В результате у той и другой пластины образуются ионы Рb••, которые соединяются с находящимися в растворе ионами SO4»в нерастворимый сернокислый свинец, и аккумулятор разряжается.
Происходящие при разряде аккумулятора процессы передает следующая схема:
Сложив написанные уравнения, нетрудно убедиться, что происходящая при разряде аккумулятора реакция обратна той, которая имела место при его зарядке. Поэтому оба процесса могут быть выражены одним уравнением:
зарядка
2PbSО4 + 2Н2О ⇄ Pb + Pb02 + 4Н• + 2SО4»
разряд
При разрядке аккумулятора концентрация серной кислоты уменьшается, так как расходуются ионы Н• и SO4» и образуется вода. Поэтому о степени разряженности аккумулятора можно судить по удельному весу кислоты, измеряя его ареометром.
Напряжение свинцового аккумулятора равно 2 вольтам и при нормальной нагрузке остается почти неизменным во время его работы. Если напряжение начинает падать, то аккумулятор необходимо снова зарядить.
Вы читаете, статья на тему Свинцовый аккумулятор

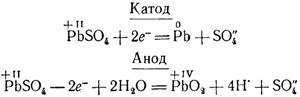
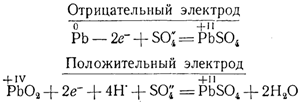
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.