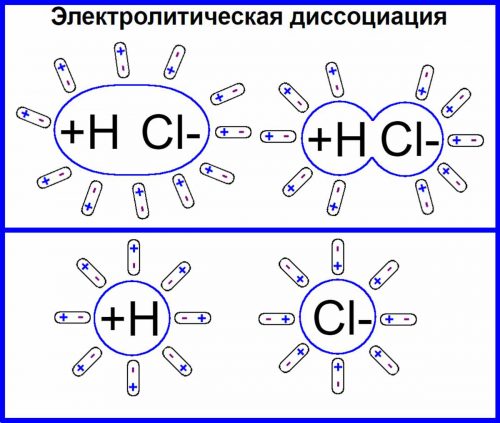
Электролитическая диссоциация — это процесс распада вещества на ионы, при взаимодействии с водой или при их расплавлении.
В водных растворах диссоциация происходит за счет взаимодействия с полярными молекулами воды.
При растворении ионных соединений ионы, находящиеся в их кристаллической решетке, гидратируются и переходят в раствор.
В случае растворения полярных веществ (например, кислот) взаимодействие их молекул с молекулами воды приводит к увеличению полярности ковалентной связи и ее превращению в ионную.
Основные положения теории электронной диссоциации
Основные положения этой теории заключаются в следующем:
Молекулы электролитов при растворении в воде в большей или меньшей степени распадаются на ионы, т. е. частицы, заряженные электричеством.
Это процесс называется электролитическая диссоциация.
Каждое вещество образует два рода ионов:
- Одни заряженные положительно.
- Другие отрицательно.
Положительно заряженными ионами кислот, оснований и солей являются ионы водорода и металлов, а отрицательно заряженными — кислотные и водные остатки.
Например, кристаллы поваренной соли NaCl распадаются на:
- Положительно заряженные ионы натрия Na+.
- Отрицательно заряженные ионы хлора Сl—.
Молекула азотной кислоты HNO3:
- На положительно заряженный ион водорода Н+.
- Отрицательно заряженный ион NO3— и т. д.
Ионы могут быть, таким образом, «простыми», или «элементарными», т. е. образованными одним атомом (Na+, Сl—), и «сложными», образовавшимися из нескольких атомов, например NO3—
Сумма положительных зарядов, приобретаемых ионами одного рода, равна сумме отрицательных зарядов ионов другого рода, вследствие чего весь раствор в целом остается электрически нейтральным.
Свойства ионов
Ионы, отличаясь от нейтральных атомов или молекул наличием электрического заряда, обладают и совершенно иными свойствами.
Например:
- Ионы водорода совсем не похожи на обыкновенный газообразный водород.
- Водород почти нерастворим в воде, а ионы водорода могут содержаться в растворе в очень большом количестве.
- Ионы натрия не действуют на воду, тогда как металлический натрий бурно реагирует с водой с образованием едкого натра.
- Ионы хлора не имеют ни запаха, ни цвета, ни других свойств газообразного хлора.
- Ионы SO4—, пока они заряжены отрицательно, могут существовать только в растворах.
- Нейтральные молекулы такого состава неизвестны.
- То же можно сказать о гидроксильных ионах и многих других.
Константа диссоциации — это константа равновесия процесса; она имеет такой вид:
СН3СООН ⇄ СН3СОО— +н+, кд = ([CH3COO—][H+])/[CH3COOH]
Процесс электролитической диссоциация
При пропускании через раствор электрического тока ионы начинают перемещаться в растворе по двум противоположным направлениям:
- Положительно заряженные ионы направляются к отрицательно заряженному электроду — катоду.
- Отрицательные ионы, наоборот, двигаются к положительному электроду — аноду.
Ионы, перемещающиеся к катоду, получили название катионов, а перемещающиеся к аноду — анионов.
Основания, или щелочи — это соединения, которые при диссоциации образуют катионы металлов и гидроксильные анионы.
Достигнув электродов, ионы разряжаются, теряя вместе с тем свои характерные свойства, обусловленные присутствием зарядов, и превращаются в нейтральные атомы или группы атомов.
Последние или выделяются из раствора или подвергаются дальнейшим изменениям, образуя новые вещества.
Существенно важным в теории Аррениуса является утверждение, что разложение на ионы происходит не под влиянием тока, как думали раньше, но уже при растворении электролита в воде.
Свободные ионы имеются во всяком растворе, способном проводить ток, независимо от того, производится ли электролиз такого раствора или нет.
Действие же тока на раствор заключается лишь в перемещении ионов к электродам, где они разряжаются.
Распад электролитов под действием растворителя на ионы получил название электролитической диссоциации или ионизации и изображается обычными химическими уравнениями в которых слева пишут формулы распадающихся веществ, а справа — образующиеся из них ионы.
Заряды находящихся в растворе свободных ионов мы будем обозначать знаками • и ‘, сохранив обозначения + и — для ионов, связанных в кристаллах солей и в других ионных соединениях.
Примером может служить диссоциация хлороводорода НCl на ионы выразится уравнением:
НCl = Н+ + Cl—
Электролиты — это вещества, которые в растворе или расплаве способны проводить электрический ток.
Неэлектролиты — это вещества, которые в растворе или расплаве не проводят электрический ток.
Определение положительно и отрицательно заряженных ионов
Присутствие в растворах электролитов положительно и отрицательно заряженных ионов может быть доказано следующим опытом.
Положительно заряженные ионы движутся к отрицательно заряженному катоду, поэтому называются катионами.
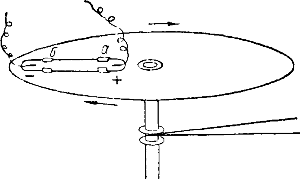
Рис. 2. Вращающийся диск с трубкой, наполненной раствором электролита.
Запаянная трубка с раствором йодистого калия KJ закрепляется на вращающемся диске (рис. 2). В трубку впаяны платиновые проволочки, к которым прикреплены платиновые электроды.
Концы проволочек при помощи особого приспособления соединены с чувствительным вольтметром.
При быстром вращении диска стрелка вольтметра заметно отклоняется, указывая на появление у электродов а и b разноименных зарядов.
При этом оказывается, что конец трубки, расположенный у края диска, заряжается отрицательно, а расположенный у центра диска — положительно.
Очевидно, что отрицательно заряженные ионы иода, как более тяжелые, отбрасываются с большей силой и потому на большее расстояние от оси вращения, чем более легкие ионы калия, заряженные положительно.
Поэтому в том конце трубки, который находится у края диска, оказывается больше ионов иода, чем калия, и расположенный там электрод заряжается отрицательно.
Отрицательно заряженные ионы движутся к положительно заряженному аноду, поэтому называются анионами.
Наоборот, на конце трубки, который находится у центра диска, оказывается больше ионов калия и появляется положительный заряды.
При таком же опыте с раствором азотнокислого серебра AgNO3 конец трубки, расположенный у края диска, где скопляются более тяжелые ионы серебра, заряжается положительно, а конец, расположенный у центра диска, — отрицательно.
Эти опыты являются хорошим доказательством действительного существования в растворах электролитов противоположно заряженных ионов.
Присутствием ионов в растворах электролитов легко объясняются те ненормальные осмотические явления.
Реакции между электролитами
Реакции между электролитами — это реакции между отдельными ионами:
NaOH + НСl = NaCl + Н2О,
Na+ + ОН— + Н+ + Cl— = Na+ + Сl— + Н2О,
Н+ + ОH— = Н2О.
Катионы слабых оснований или анионы слабых кислот в водных растворах взаимодействуют с молекулами воды, образуя не диссоциированные молекулы.
И освобождают соответственно ионы водорода или гидроксильные ионы — создавая кислотную или щелочную среду.
Этот процесс называется гидролизом:
NH4CI + Н2О ⇄ NH4OH + HСІ;
или
NH4+ +Н2О ⇄ NH4OH + Н+
KF + H2O ⇄ KOH + HF;
или
F— + H2O ⇄ HF + OH—.
Кислотность или щелочность среды можно выражать концентрацией ионов водорода или гидроксильных ионов.
Исходя из константы диссоциации воды, произведение концентраций водородных и гидроксильных ионов при 25ºС — величина постоянная, называется ионным произведением воды и равно:
КН2О + [H+][OH—] = 10-14.
При отсутствии посторонних ионов водорода или гидроксильных ионов среда должна быть нейтральной и при этом
[H+] = [OH—] = 10-7 моль/л.
Кислотность среды чаще всего выражают не концентрацией ионов водорода, а водородным показателем pH — отрицательным логарифмом концентрации ионов водорода —
рН = — 1g[H+]. проверить
В нейтральной среде pH = 7, в щелочной pH > 7, в кислой pH < 7.
Влияние осмотического давления
«Молекула» поваренной соли (во времена Аррениуса еще не было известно, что в кристаллах поваренной соли нет отдельных молекул, распадается в растворе на два иона:
Na•и Сl’.
Если все перешедшие в раствор «молекулы» диссоциируют на ионы, то число образовавшихся ионов будет вдвое больше числа взятых молекул.
Из грам-молекулы поваренной соли получится не 6,02 • 1023 частиц, а вдвое большее их число.
А так как осмотическое давление зависит не от природы находящихся в растворе частиц, а только от их числа, то оно тоже должно увеличиться вдвое.
Точно так же в очень разбавленном растворе хлористого бария, диссоциирующего по уравнению:
ВаСl2 = Ва•• + 2Сl’
осмотическое давление оказывается втрое больше, чем вычисленное по закону Вант-Гоффа, так как число частиц в растворе втрое больше, чем если бы хлористый барий находился в нем в виде молекул ВаСl2.
Таким образом, особенность водных растворов электролитов, противоречащая с первого взгляда закону Вант-Гоффа, была объяснена на основе этого же закона.
Однако теория Аррениуса не учитывала всей сложности явлений в растворах.
Являясь по существу механистической, она рассматривала ионы как совершенно свободные, независимые от молекул растворителя частицы.
Теории Аррениуса противостояла химическая, или гидратная, теория Менделеева, в основе которой лежало представление о взаимодействии растворенного вещества с растворителем (о соединении частиц растворенного вещества с частицами растворителя).
Соли — это соединения, которые при диссоциации образуют катионы металла и анионы кислотного остатка. Кислые соли образуют еще катионы водорода, а основные соли — гидроксильные анионы.
История
В 1877 г. в одном из научных журналов появилась статья Аррениуса «О диссоциации растворенных в воде веществ».
В этой статье Аррениус, приводя результаты своих исследований по электропроводности растворов, обращает внимание на тесную связь между способностью растворов проводить электрический ток и неподчинением тех же растворов законам Рауля и Вант-Гоффа.
Аррениус показал, что, измерив электропроводность раствора, можно рассчитать величину его осмотического давления, а следовательно, и поправочный коэффициент для данного раствора.
Величины i, выведенные им из электропроводности, очень близко совпали с величинами, найденными Вант-Гоффом для тех же растворов иными методами.
Причиной чрезмерно высокого осмотического давления раствора электролитов является, по мнению Аррениуса, диссоциация молекул электролитов на заряженные электричеством частицы, которые он назвал ионами.
От этого, с одной стороны, увеличивается общее число частиц в растворе, а следовательно, и осмотическое давление, с другой стороны, образовавшиеся ионы сообщают раствору способность проводить ток.
Предположения, высказанные Аррениусом в упомянутой выше статье, были им развиты в дальнейшем в стройную теорию, получившую название теории электролитической диссоциации или ионной теории.
Иван Алексеевич Каблуков и теория электролитической диссоциации
Заслуга преодоления кажущегося противоречия обеих теорий принадлежит И. А. Каблукову, впервые высказавшему очень важное предположение о гидратации ионов, т. е. об образовании ими неустойчивых соединении с молекулами воды.
Это предположение, являющееся сейчас неоспоримым фактом, привело в дальнейшем к объединению теорий Аррениуса и Менделеева.
Все последующее развитие химии растворов показало, что теория электролитической диссоциации не только не противоречит гидратной теории, но и не может развиваться иначе, как на основе представлений, созданных Менделеевым.

Иван Алексеевич Каблуков родился 2 сентября 1857 г. в селе Пруссы Московской губернии.
Окончив Московский университет в 1880 г., он работал первое время в области органической химии.
В 1889 г. Иван Алексеевич отправляется в Лейпциг, в лабораторию Оствальда, где работает некоторое время, вместе с Аррениусом, по электропроводности растворов.
По возвращении в Россию он продолжает исследования в области электропроводности растворов.
Результатом их является его докторская диссертация «Современные теории растворов (Вант-Гоффа и Аррениуса) в связи с учением о химическом равновесии», оказавшая большое влияние на развитие физической химии в России и способствовавшая дальнейшему развитию теории электролитической диссоциации.
Из многочисленных работ Каблукова особенно важными являются также его исследования в области солевых равновесий.
Всю свою жизнь И. А. Каблуков вел большую педагогическую и культурно-просветительную работу.
Он читал лекции в Московском университете и в Сельскохозяйственном институте, написал учебники «Основные начала неорганической химии» и «Основные начала физической химии», по которым училось не одно поколение химиков, состоял членом многих научных обществ.
Быстрые ответы?
Это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы.
Примером такой реакции может служить хлороводород HCl и вода H2O.
Является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
В растворе ионы существуют в гидратированном виде, в отличие от безводных солей, в которых ионы негидратированные.
Это отношение количества молекул, что про диссоциировали, к общему количеству молекул электролита в растворе.
По степени диссоциации электролиты делятся на сильные (более 40 %), средние (9-40%) и слабые (менее 9% в0,1 М растворе).
С точки зрения электролитической диссоциации, кислоты — это соединения, которые при диссоциации образуют катионы водорода и анионы кислотного остатка.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.