Химические реакции подразделяют на несколько типов реакций:
- Реакции разложения, (А → А + В)
- Реакции соединения, (А + В → АВ).
- Замещения, (А + ВD → AB + D).
- Обмена, (АB + DC → AC + DB)
- Обратимые реакции, (А + В ⇄ АВ).
- Необратимые реакции, (А + В → АВ).
- Окислительно восстановительной реакции.
- Экзотермические реакции.
- Термохимические реакции.
Химические реакции: типы и примеры
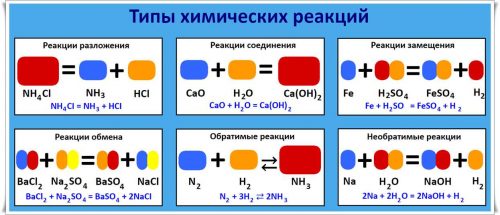
Реакции разложения — это такие реакции, в результате которых из одного вещества образуется несколько новых веществ.
Пример реакции разложения:
NH4CI = NH3 + HCI.
Реакции соединения — это такие реакции, в результате которых из двух или нескольких веществ образуется одно новое вещество.
Пример реакции соединения:
СаО + Н2О = Са(ОН)2.
Реакции замещения — это такие реакции, входе которых число веществ не изменяется, а происходит замещение составной части сложного вещества простым веществом.
Пример реакции замещения:
Fe + H2SO4 = FeSO4 + H2.
Реакции обмена — это такие реакции, в процессе которых молекулы двух веществ обмениваются составными частями, образуя молекулы двух новых соединений.
В этом случае число вступивших в реакцию веществ равно числу образовавшихся соединений.
Пример реакции обмена:
ВаСl2 + Na2SO4 = BaSO4 + 2NaCI.
Теплота образования соединения — это количество теплоты, выделяющейся или поглощаемой при образовании одного моля химического соединения из простых веществ.
Экзотермическая реакция — это реакция, сопровождающаяся выделением тепла.
Пример экзотермической реакции:
СН4 + 2О2 = СО2 + 2Н2О + 892 кДж.
Эндотермическая реакция — это реакция, сопровождающаяся поглощением тепла.
Пример эндотермической реакции:
СаСО3 + Н2О =
Закон Гесса: тепловой эффект реакции зависит от состояния исходных веществ и конечных продуктов, но не зависит от промежуточных стадий реакции.
Термохимическое уравнение реакции — это уравнение реакции, для которой указан ее тепловой эффект.
Пример термохимической реакции:
2Р + 2,5О2 = Р2О5 + ∆Н.
Окислительно-восстановительными реакциями называются такие, при которых изменяется степень окисления отдельных элементов.
Пример окислительно восстановительной реакции:
2KMn+7O4 + 16HCl-1 = 2KCl + 2Mn+2Cl2 + 5Cl02 + 8H2O
Обратимые реакции — это реакции, протекающие при данных условиях в двух противоположных направлениях.
Пример обратимой реакции, азот и водород:
N2 + 3H2 ⇄ 2NH3
Необратимые реакции — это реакции, которые протекают только в одном направлении.
Пример необратимых реакций, натрий и вода:
2Na + 2H2O → 2NaOH + H2
Быстрые ответы?
Реакции разложения. Реакции соединения. Замещения. Обмена. Обратимые реакции. Необратимые реакции. Окислительно восстановительной реакции. Экзотермические реакции. Термохимические реакции
Можно классифицировать по различным признакам: по числу и составу исходных веществ и продуктов реакции; по агрегатному состоянию; по тепловому эффекту; по изменению степени окисления; по наличию или отсутствию катализатора; по признаку обратимости.
Можно представить в виде общей схемы:
AB + C = AC + B ,
где A, B, C — условные обозначения составных частей веществ.