Серный ангидрид это неорганическое сложное вещество, в состав которого входят сера S и кислород O2.
Химическая формула сернистого ангидрида SO3, в недавнем прошлом применялся для получения серной кислоты.
Серная кислота может растворять значительные количества серного ангидрида. Такие растворы носят название олеумов.
Из них можно выделить твердое соединение серной кислоты с серным ангидридом, называемое пиросерной кислотой, H2S2O7.
Что такое сернистый ангидрид SO3
Сернистый ангидрид может присоединять к себе кислород, переходя при этом в серный ангидрид.
При обычных условиях непосредственное соединение сернистого ангидрида с кислородом происходит чрезвычайно медленно.
Гораздо быстрее и легче протекает реакция при высокой температуре и в присутствии некоторых катализаторов, как-то: мелко раздробленной платины, окислов ванадия, железа, хрома и др.
SO2 газ, его окисление до SO3 в обычных условиях протекает очень медленно, поэтому для ускорения реакции используют катализатор ( оксидов ванадия, платина и др.).
Реакция протекает при 450°C.
Получение оксида серы
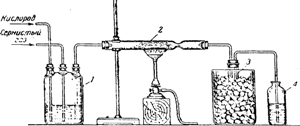
Для получения небольшого количества серного ангидрида в лаборатории можно воспользоваться прибором, изображенным на рис..
Через трехгорлую склянку 1 с концентрированной серной кислотой пропускают для осушения кислород и сернистый газ.
Из склянки смесь обоих газов поступает в трубку 2, содержащую платинированный асбест (асбест с нанесенной на него мелко раздробленной платиной); трубка нагревается горелкой.
Здесь происходит соединение кислорода с сернистым газом:
2SO2 + O2 ⇄ 2SO3
Пары образующегося серного ангидрида вместе с избытком газов переходят в охлаждаемую льдом колбу 3.
В колбе часть серного ангидрида сгущается, а не успевшие сгуститься пары попадают в склянку 4, где, соединяясь с водой, дают серную кислоту.
Чистый серный ангидрид
Чистый серный ангидрид представляет собой бесцветную легкоподвижную жидкость уд. веса 1,92, кипящую при 44,8° и застывающую при 16,8° в кристаллическую прозрачную массу.
При хранении, особенно в присутствии следов влаги, это вещество видоизменяется, превращаясь в длинные шелковистые кристаллы, которые при 50°, не плавясь, возгоняются.
Вторая модификация серного ангидрида имеет молекулярный вес, соответствующий-формуле (SO3)x.
Серный ангидрид жадно соединяется с водой, выделяя большое количество тепла и образуя серную кислоту:
SO3 + Н2О = H2SO4 + 21 ккал
Вы читаете, статья на тему Серный ангидрид SO3

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.