Серебро (Argentum) это
В 1956 г. добыча серебра в капиталистических странах составила 5,7 тыс: т. Из этого количества почти половина добыта в Мексике и США.
Добыча Ag
В СНГ серебро добывается из серебро-свинцовых руд, месторождения которых имеются на Урале, Алтае, Северном Кавказе, в Казахстане и некоторых других местах.
При переработке медных и свинцовых руд, содержащих серебро, последнее выделяется вместе с этими металлами в свободном состоянии. От меди оно обычно отделяется при электролитической очистке сырой меди . Для извлечения же серебра из сплавов со свинцом применяют один из следующих двух способов.
Первый способ заключается в том, что содержащий серебро свинец (так называемый «веркблей») плавят и дают ему медленно остывать. При охлаждении на поверхности сплава выделяются кристаллы чистого свинца, которые вычерпывают ковшами. Когда таким образом остаток обогатится серебром, его подвергают окислению, продувая через него сильную струю воздуха. Свинец переходит при этом в окись свинца, а серебро остается в чистом виде.
Второй способ основан на том, что расплавленный цинк не смешивается с расплавленным свинцом, а серебро гораздо лучше растворяется в расплавленном цинке, чем в свинце.
При прибавления цинка к расплавленному свинцу, содержащему серебро, все серебро почти полностью переходит в цинк, который затем вычерпывают и подвергают перегонке. Оставшееся после отгонки цинка серебро очищают от небольшой примеси свинца так же, как при первом способе.
Чистое серебро это
Чистое серебро — очень мягкий, тягучий металл уд. ; веса 10,49, плавящийся при 960,8°. Оно лучше всех металлов проводит тепло и электрический ток.
На практике серебро вследствие мягкости почти не применяется в чистом виде; обычно его сплавляют с большим или меньшим количеством меди. Сплавы серебра служат для приготовления домашней утвари, ювелирных изделий, серебряных монет. Содержание серебра в сплаве указывает проба. Проба показывает, сколько частей чистого серебра находится в 1000 частях сплава. В СНГ для изготовления серебряных изделий применяют серебро 875 пробы, т. е. содержащее 87,5% серебра и 12,5% меди . Большая часть добываемого серебра идет на покрытие им других металлов, что осуществляется в настоящее время исключительно гальваническим путем.
В последнее время серебро расходуют в значительных количествах на изготовление аккумуляторов.
В серебряно-цинковых аккумуляторах положительными электродами являются пластинки из чистого серебра, а отрицательными — пластинки из окиси цинка. Электролитом служит раствор едкого кали. Эти аккумуляторы имеют ряд преимуществ перед железо-никелевыми и свинцовыми аккумуляторами и, несмотря на сравнительно высокую стоимость, получили значительное распространение.
Основными преимуществами серебряно-цинковых аккумуляторов являются:
1) большая емкость при сравнительно малом весе;
2) возможность работы в широком интервале температур (от —60°)
3) хорошая хранимость в заряженном состоянии;
4) возможность использования в значительных пределах изменения атмосферного давления.
Химические свойства металла
Серебро принадлежит к наименее активным металлам, занимая в ряду напряжений одно из последних мест. Оно не окисляется на воздухе ни при обыкновенной температуре, ни при нагревании. Наблюдаемое часто почернение серебряных предметов происходит вследствие образования черного сульфида серебра Ag2S под влиянием содержащегося в воздухе сероводорода, а также при соприкосновении с пищевыми продуктами, содержащими сернистые соединения.
Соляная и разбавленная серная кислоты не действуют на серебро. Растворяют серебро обычно в азотной кислоте.
Серебро образует только один ряд солей, растворы которых содержат бесцветные катионы Ag•
Соли серебра
Окись серебра Ag2О. При действии щелочей на растворы серебряных солей можно было бы ожидать получения гидрата окиси серебра AgOH, но вместо него выпадает бурый осадок окиси серебра:
2AgNO3 + 2NaOH = 2NaNO3 + Ag2O + H2O
В большом количестве воды окись серебра заметно растворяется, сообщая раствору щелочные свойства. Такой раствор окрашивает лакмус в синий цвет и, подобно щелочам, осаждает гидраты окисей многих металлов из растворов их солей. Очевидно, в растворе содержится некоторое количество гидрата окиси серебра AgOH, представляющего собой довольно сильное основание. Последнее обстоятельство подтверждается также тем, что соли серебра не гидролизуются.
Кроме окиси серебра, известна также перекись серебра Ag2O2, образующаяся при действии на серебро озона.
Из солей серебра наиболее важными являются следующие:
1. Нитрат серебра, или азотнокислое серебро AgNO3, называемое также ляписом. Образует бесцветные прозрачные кристаллы, легко растворимые в воде. Получается путем растворения серебра в азотной кислоте. Применяется в медицине для прижигания, так как ион серебра действует на органические вещества окисляющим образом, восстанавливаясь сам до металлического серебра. Служит исходным веществом при получении других соединений серебра. Применяется в фотографической промышленности, в производстве зеркал, в гальванопластике.
2. Хлорид серебра, или хлористое серебро AgCl. Образуется в виде белого, творожистого, нерастворимого в воде и кислотах осадка при встрече ионов Ag• с ионами Сl. На свету хлористое серебро постепенно темнеет, разлагаясь с выделением металлического серебра. Такими же свойствами обладают бромистое и йодистое серебро, имеющие, в отличие от хлористого серебра, желтоватый цвет. Напротив, фтористое серебро AgF растворимо в воде.
Комплексные соединения серебра. Подобно меди, серебро обладает ярко выраженной склонностью к образованию комплексных соединений.
Многие нерастворимые в воде соединения серебра как, например, Ag2O, AgCl и др., легко растворяются в водном аммиаке. Причиной растворения является образование комплексных аммиачно-серебряных ионов [Ag(NH3)2]• при встрече молекул аммиака с ионами серебра.
Происходящий процесс в случае, например, хлористого серебра можно изобразить в виде следующей схемы:
Хлористое серебро посылает в раствор некоторое количество ионов Ag• после чего между ними и осадком устанавливается динамическое равновесие. При прибавлении аммиака молекулы его связываются с ионами серебра в комплексные ионы [Ag(NH3)2]• и равновесие непрерывно смещается вправо, пока весь осадок не растворится. Таким образом, в аммиачном растворе серебро находится в виде комплексных катионов [Ag(NH3)2]•. Но наряду с ними в растворе всегда остается и некоторое, хотя и незначительное, количество ионов Ag• вследствие диссоциации комплексного иона по уравнению
[Ag(NH3)2]• ⇄ Ag• +2NH3
Если на полученный раствор подействовать щелочью, то никакого осадка не образуется, хотя растворы обыкновенных солей серебра, как мы видели выше, тотчас дают осадок Ag2O.Очевидно, концентрация ионов серебра в аммиачном растворе слишком мала, чтобы при введении в него даже избытка гидроксильных ионов можно было достигнуть величины произведения растворимости AgOH(ПРAgOH= 2 • 10-8). Однако после прибавления йодистого калия выпадает осадок йодистого серебра. Это доказывает, что ионы Ag• все же имеются в растворе. Как ни мала их концентрация, но она оказывается достаточной для образования осадка, так как произведение растворимости AgJ составляет только 1 • 10-16, т. е. значительно меньше, чем у AgOH. Точно так же при действии сероводорода получается осадок Ag2S,произведение растворимости которого равно 1 • 10—49.
Диссоциация ионов [Ag(NH3)2]• согласно приведенному выше уравнению,, как и диссоциация всякого слабого электролита, подчиняется закону действия масс и может быть охарактеризована соответствующей константой, называемой константой нестойкости комплексного иона:
Константы нестойкости для различных комплексных ионов весьма различны и могут служить мерой устойчивости комплекса.
Особенной устойчивостью обладают комплексные анионы, об разующиеся путем соединения ионов Ag• с ионами CN’.
Если к раствору AgNО3 прибавить цианистого калия, то выпадает белый осадок цианистого серебра:
Ag• + CN’=↓AgCN
В избытке цианистого калия осадок легко растворяется, переходя в комплексную соль K[Ag(CN)2], существующую в растворе в виде ионов К• и [Ag(CN)2]’: AgCN + KCN = К[ Ag(CN)2]
или в ионной форме
AgCN + CN’ = [Ag(CN)2]’
При выпаривании раствора K[Ag(CN)2] выделяется в твердом виде.
Ион [Ag(CN)2]’ чрезвычайно устойчив; константа его нестойкости равна 1 • 10—21. Поэтому даже прибавление к раствору K[Ag(CN)2] йодистого калия не вызывает образования осадка AgJ. Но при действии сероводорода, ввиду ничтожно малой величины произведения растворимости сульфида серебра, все же выпадает осадок Ag2S.
Применение металла
Комплексные цианистые соединения серебра применяются для гальванического серебрения, так как при электролизе растворов обыкновенных солей серебра не образуется плотно пристающего слоя. При пропускании тока через раствор K[Ag(CN)2] на катоде выделяется серебро за счет того незначительного количества ионов Ag•, которое получается вследствие диссоциации комплексного аниона:
[Ag(CN)2]’⇄Ag•+2CN’
Все соединения серебра легко восстанавливаются с выделением металлического серебра.
Если к аммиачному раствору окиси серебра, находящемуся в стеклянном сосуде, прибавить в качестве восстановителя немного глюкозы или формалина, то металлическое серебро выделяется в виде плотного блестящего зеркального слоя на поверхности стекла. Этим способом в настоящее время готовят зеркала, а также серебрят внутреннюю поверхность стеклянных сосудов в термосах для уменьшения потери тепла путем лучеиспускания.
Фотография. Соли серебра, особенно хлористая и бромистая, ввиду их способности разлагаться под влиянием света с выделением металлического серебра, широко используются в фотографии для приготовления светочувствительных пластинок, пленок и бумаг.
Фотографические пластинки и пленки изготовляются следующим образом. К теплому раствору азотнокислого серебра прибавляют некоторое количество желатины и смешивают его с раствором КВr. Образуются бромистое серебро и азотнокислый кглий согласно уравнению
AgNO3 + КВr = AgBr + KNO3
Вследствие защитного действия желатины бромистое серебро не выпадает в осадок, а остается в растворе в виде тончайшей мути. Полученная мутная жидкость носит название «бромосеребряной эмульсии» (правильнее было бы сказать — суспензии). Так как в очень мелко раздробленном виде AgBr мало светочувствительно, то эмульсию оставляют на некоторое время в теплом месте, пока не произойдет так называемый процесс созревания, состоящий в уменьшении степени дисперсности бромистого серебра и образовании более крупных частиц: от этого светочувствительность AgBr увеличивается в сотни раз.

По окончании процесса созревания эмульсию охлаждают, полученный студень желатины дробят и промывают водой для удаления KNO3, затем, расплавив студень, обливают им стеклянные пластинки или целлулоидныепленки. Все эти процессы ведутся при красном све те, который не действует на бромистое серебро.
Если фотографическую пластинку выставить на свет, то потемнение ее происходит довольно медленно. Однако этот процесс может быть чрезвычайно ускорен действием на пластинку различных веществ, называемых проявителями. Замечательно, что проявитель может разлагать (восстанавливать) бромистое серебро лишь после того, как оно подвергалось освещению, хотя бы даже очень непродолжительное время (доли секунды).
Чтобы получить на фотографической пластинке изображение снимаемого предмета, ее помещают в фотографическую камеру и в течение очень короткого времени подвергают действию лучей, проходящих через объектив аппарата (систему собирающих линз) и дающих на пластинке изображение предмета. Если затем опустить пластинку в раствор какого-нибудь проявителя (это делается в темной комнате при красном свете), то подвергшиеся освещению места пластинки довольно быстро темнеют и на пластинке появляется изображение снятого предмета. Такой, процесс называется проявлением.

После проявления полученное изображение закрепляют (фиксируют), опуская пластинку в раствор тиосульфата натрия (гипосульфита) Na2S2O3. В этом растворе неразложившееся еще бромистое серебро растворяется вследствие образования ионами серебра и тиосульфата комплексных ионов, имеющих, вероятно, состав [Ag(S2O3)]’:
Ag• + S2O»3 = [Ag(S2O3)]’
Таким образом получается негатив, т. е. обратное изображение, на котором светлые части снятого предмета являются темными и, наоборот, темные — светлыми (рис. 145).
С негатива можно получить нормальное изображение или позитив (рис. 146) на светочувствительной бумаге, приготовляемой так же, как пластинки Для этого негатив накладывают на бумагу и на короткое время выставляют на свет. Затем бумагу проявляют и фиксируют.
Существуют также бумаги, светочувствительный слой которых содержит хлористое серебро. На таких бумагах печатают без последующего проявления, выдерживая бумагу под негативом на свету, пока на Ней не получится видимое изображение, после чего отпечаток фиксируют.
Вы читаете, статья на тему Серебро (Argentum)


![образование комплексных аммиачно-серебряных ионов [Ag(NH3)2] образование комплексных аммиачно-серебряных ионов [Ag(NH3)2]](https://znaesh-kak.com/wp-content/uploads/2016/04/SAM_2129-1.png)
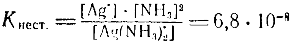
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.