Растворы это твердая или жидкая гомогенная система, состоящая из двух или более компонентов (составных частей), относительные количества которых могут изменяться в довольно широких пределах.
Наиболее важный вид растворов — это жидкие растворы. Смеси соль — вода, сахар — вода, этиловый спирт — вода называются растворами.
Что такое растворы
Растворы имеют весьма важное значение в жизни и практической деятельности человека. Достаточно указать, что процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор.
Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т. д.).
Наконец, все производства, в основе которых лежат химические процессы, связаны в той или иной мере с использованием различных растворов.
Раствор находиться в промежуточном состоянии между химическими и механическими смесями, а также бывают пересыщенными.
Примеры образования растворов
Хлористый натрий, сахар, этиловый спирт и вода представляют собой чистые вещества.
Каждое из этих веществ характеризуется определенными свойствами, например давлением пара, температурой плавления, температурой кипения, плотностью.
Предположим, что мы смешиваем некоторые из этих веществ. Хлористый натрий, внесенный в воду, растворяется в ней. Твердое вещество исчезает, переходя в жидкую фазу.
Точно так же растворяется в воде сахар. Если добавить к воде этиловый спирт, то два чистых вещества смешиваются и образуют жидкость, по внешнему виду похожую на воду и спирт.
От чистых веществ растворы отличаются тем, что их свойства изменяются в зависимости от относительных количеств растворителя и растворенного вещества.
Растворы при фазовых переходах ведут себя совсем иначе, чем чистые вещества.
Это позволяет провести строгое разграничение между растворами и чистыми веществами и служит основой для решения вопроса о том, является данное вещество чистым веществом или раствором.
Пересыщенные растворы
Пересыщенные растворы это неустойчивые системы, которые могут существовать только при условии, что в состав раствора не входят твердые частицы растворенного вещества.
Это явление открыл русский академик Т. Е. Ловицем (1794 г.), который назвал такие растворы пересыщенными.
Он провел опыт с медленным охлаждением растворенного вещества, позаботившись о там , чтобы в него не попали твердые частицы растворенного вещества.
Так при удачном опыте добавление кристалла того вещества, то во круг него за счет пересыщенного состояния начинают образовываться другие кристаллы.
Иногда кристаллизация образовывалась от простого сотрясения, удара или трения палочки стенки. Это явление протекало с выделением значительного количества тепла.
Формула пересыщенного раствора:
СМ — Сn = p,
где СМ — концентрация пересыщенного раствора,
Сn — концентрация насыщенного раствора, p — пересыщение.
Формула относительного пересыщения раствора:
(СМ — Сn )/Сn = pотн.
Коллоидные растворы
Это растворы которые отличаются свойствами от истинных растворов и грубодисперсных систем.
Примером коллоидного раствора может быть растворенное в воде мыло, а если его растворить в спирте то это будет истинный.
Отличить истинный раствор от коллоидного можно проделав опыт с банкой у которой нет дна, его нужно закрыть пергаментом и налить в него раствор хлорида натрия.
Опустить банку с водой и через время вкус воды станет соленым, а если в место хлорида натрия добавить белок от яйца, то его не обнаружится во второй банке.
Коллоидные растворы не могут проникать через перегородки, а истинные да.
Поэтому этим свойством пользуются для отделения истинных растворов (примеси растворимых солей), от коллоидных растворов.
Газообразные растворы
Это смеси газов которые гомогенны, поэтому все они являются растворами. Примером может служить воздух.
Существует только одна фаза — газовая, когда все молекулы независимо от их происхождения ведут себя как молекулы газа.
Сами молекулы могут быть получены из газообразных, жидких или твердых веществ, но независимо от их происхождения газовый раствор — воздух — является гомогенной фазой.
Как и другие растворы, путем фазовых переходов воздух можно разделить на компоненты.
Твердые растворы
Твердые растворы встречаются реже. Устойчивость кристаллов определяется закономерностью в расположении атомов.
Посторонний атом нарушает эту закономерность и, следовательно, уменьшает устойчивость кристалла.
Поэтому при образовании кристалла наблюдается тенденция к удалению посторонних атомов из кристаллической решетки.
Вот почему перекристаллизация является хорошим методом очистки вещества.
Пример твердых растворов
Однако металлы довольно часто образуют твердые растворы. Атомы одного элемента могут входить в кристалл другого элемента, если они близки по размерам.
Золото и медь образуют такие твердые растворы. Атомы золота могут замещать атомы меди в кристалле меди.
Атомы меди тоже могут замещать атомы золота в кристалле золота.
Подобные твердые растворы называются сплавами.
Некоторые твердые металлы растворяют водород или углерод. Например, сталь — это железо, содержащее небольшое количество растворенного углерода.
Жидкие растворы
Это вещества которые растворены в растворители, в основном в качестве растворителя используется вода.
В лабораторной практике мы имеем дело преимущественно с жидкими растворами. Они могут быть получены смешением двух жидкостей (например, спирта и воды).
Растворением газа в жидкости (например, двуокиси углерода в воде) или растворением твердого вещества в жидкости (например, сахара в воде).
В результате образуется гомогенная система — раствор, который состоит более чем из одного компонента. В случае жидкого раствора компоненты взаимно разбавляются.
В соленой воде соль разбавляет воду, а вода, разумеется, разбавляет соль.
Этот раствор только частично состоит из молекул воды. Было показано, что давление пара раствора соответственно ниже, чем давление пара чистой воды.
Если вода должна быть нагрета до 100° С, чтобы ее давление пара возросло до 760 мм рт. ст., то для достижения такого же давления пара раствор соли необходимо нагреть до более высокой температуры.
Следовательно, температура кипения соленой воды выше, чем температура кипения чистой воды. Степень повышения температуры кипения раствора зависит от относительных количеств воды и соли.
Чем больше соли растворяют в воде, тем выше температура кипения раствора.
Пример использования жидкого раствора
Аналогично этому соленая вода и раствор спирта в воде замерзают при более низких температурах, чем чистая вода.
На этом основано действие антифризов, которые добавляют к воде, используемой в автомобильных радиаторах.
Антифризы растворяются в воде, залитой в радиатор, и понижают ее температуру замерзания. Степень понижения температуры замерзания также зависит от относительных количеств воды и антифриза.
Таким образом, свойства растворов зависят от соотношения компонентов. Разумеется, очень большое значение имеет количественное определение состава раствора. Это можно проделать различными способами.
Механизм растворения соли
Повседневно сталкиваясь с растворами, человек давно интересовался их свойствами, однако основные закономерности, определяющие поведение растворов, были установлены только в XVIII веке.
Много внимания уделял изучению растворов М. В. Ломоносов. Он исследовал влияние температуры на растворение различных веществ:
1) Тепловые явления при растворении,
2) Замерзание растворов,
3) Явления кристаллизации и др.
Он же установил, что процесс растворения всегда сопровождается энергетическим эффектом и в связи с этим указал на необходимость строго различать два случая растворения:
1) Растворение, сопровождающееся выделением тепла, как, например, растворение металлов в кислотах, являющееся по существу химическим взаимодействием кислоты с металлом.
Так как при выпаривании раствора выделяется не взятый металл, а его соль, образованная данной кислотой.
2) Растворение, идущее с поглощением тепла, как, например, растворение соли в воде, при котором не происходит химического изменения растворяемого вещества.
И при выпаривании раствора кристаллизуется та же соль, которая была взята для растворения.
Характеристика растворов
Всякий раствор состоит из растворенного вещества и растворителя, т. е. среды, в которой это вещество равномерно распределено в виде молекул или еще более мелких частиц — ионов.
Однако не всегда легко определить, какое вещество является растворителем и какое — растворенным веществом.
Обычно растворителем считают тот компонент, который в чистом виде существует в таком же агрегатном состоянии, что и полученный раствор (например, в случае водного раствора соли растворителем, конечно, является вода).
Если оба компонента до растворения находились в одинаковом агрегатном состоянии (например, спирт и вода), то растворителем считается компонент, находящийся в большем количестве.
Однородность растворов делает их очень сходными с химическими соединениями.
Выделение тепла при растворении некоторых веществ тоже указывает на известного рода химическое взаимодействие между растворителем и растворяемым веществом.
Отличие растворов от химических соединений состоит в том, что состав последних постоянен, а состав раствора, приготовленного из данных компонентов, может иногда изменяться в довольно широких пределах.
Кроме того, в свойствах раствора можно обнаружить многие свойства его отдельных компонентов, чего не наблюдается в случае химического соединения.
Непостоянство состава растворов приближает их к механическим смесям, однако от последних они резко отличаются своею однородностью.
Таким образом, растворы занимают промежуточное положение между механическими смесями и химическими соединениями.
Какая разница между чистым веществом и раствором
Земная кора состоит из многих непохожих друг на друга частей — она неоднородна, или гетерогенна.
Некоторые ее части однородны, или гомогенны. Хорошо известными примерами гетерогенных веществ являются гранит, состоящий из смеси различных минералов.
А также приправа к салату, состоящая из капель масла, суспендированных в водной уксусной кислоте и черный дым, состоящий из взвеси частиц сажи в воздухе.
Примерами гомогенных веществ являются алмаз, чистая вода, соленая вода и чистый воздух. Гетерогенные вещества довольно трудно описать и классифицировать. Гомогенные вещества можно описать довольно точно.
Как чистые вещества, так и растворы являются гомогенными. Гомогенное вещество, состоящее только из одного вещества, называется чистым веществом. Растворы — это гомогенное вещество, состоящее из двух или нескольких веществ.
Мы употребляем термины газовая фаза, жидкая фаза, твердая фаза.
Что такое фаза вещества
Фаза — это гомогенная часть системы, которая характеризуется одинаковыми свойствами и составом. В свою очередь системой называется область и вещество в ней, которое мы рассматриваем.
Система может состоять из одной или нескольких фаз.
Для примера сравним два жидких образца — чистую воду и соленую воду. Оба образца — гомогенные системы, состоящие из одной фазы.
Однако первая жидкость представляет собой чистое вещество, а вторая — раствор. Мы не можем только по внешнему виду сказать, какая из этих прозрачных жидкостей — чистое вещество и — какая — раствор.
Правда, между ними существует различие — например, соленая вода имеет больший удельный вес, чем чистая, но это свойство не показывает, какой из образцов — чистое вещество.
Пример сравнения фаз вещества
Сравним поведение этих двух систем при фазовом переходе. Сначала посмотрим, что происходит с водой при замерзании или испарении. Чистая вода замерзает при определенной температуре, равной 0° С.
Заморозим половину воды, поместим образовавшийся лед в другой сосуд, расплавим его и сравним полученные образцы воды. Оказывается, их нельзя различить.
Далее, если испарить половину воды, сконденсировать образовавшийся пар в другом сосуде и сравнить образцы воды, мы увидим, что их тоже нельзя отличить друг от друга.
Такое поведение при испарении (и конденсации), а также при замерзании (и плавлении) характеризует чистые вещества.
Растворы ведут себя совсем иначе.
Пример растворов
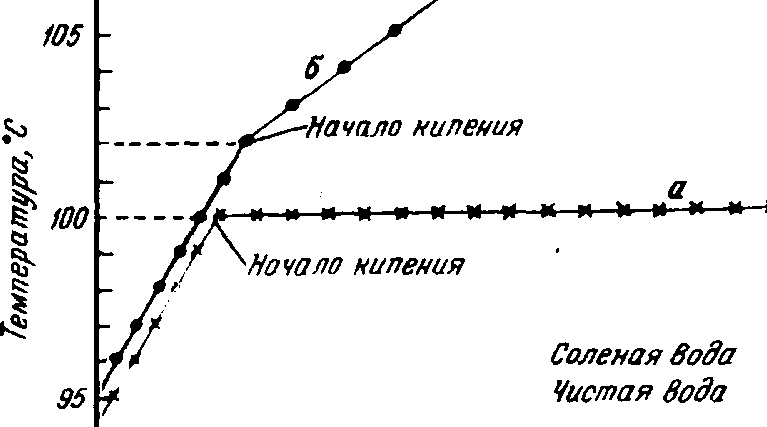
То, что с чистой водой этого не происходит, можно видеть по кривой а рис. : температура кипения соленой воды выше, чем чистой.
Температура чистой воды при кипении остается постоянной, в то время как температура кипения соленой воды повышается. По мере повышения температуры кипения концентрация соли в воде увеличивается.
Если собрать пар, образующийся при кипении соленой воды, и сконденсировать его в отдельном сосуде, то мы обнаружим, что эта жидкость по своим свойствам напоминает чистую воду, а не раствор, из которого она получена.
После испарения всей воды остается твердая соль. Таким образом, путем перегонки, т. е. испарением и последующей конденсацией в другом сосуде.
Можно отделить чистую жидкость от раствора, а путем кристаллизации, т. е. образования кристаллического твердого вещества, можно получить чистое твердое вещество из раствора.
Химики называют чистую жидкость, полученную при перегонке раствора, и чистое твердое вещество, полученное при кристаллизации, компонентами раствора. В нашем опыте, иллюстрированном рис. , компонентами являются соль и вода.
Пример разделения растворов
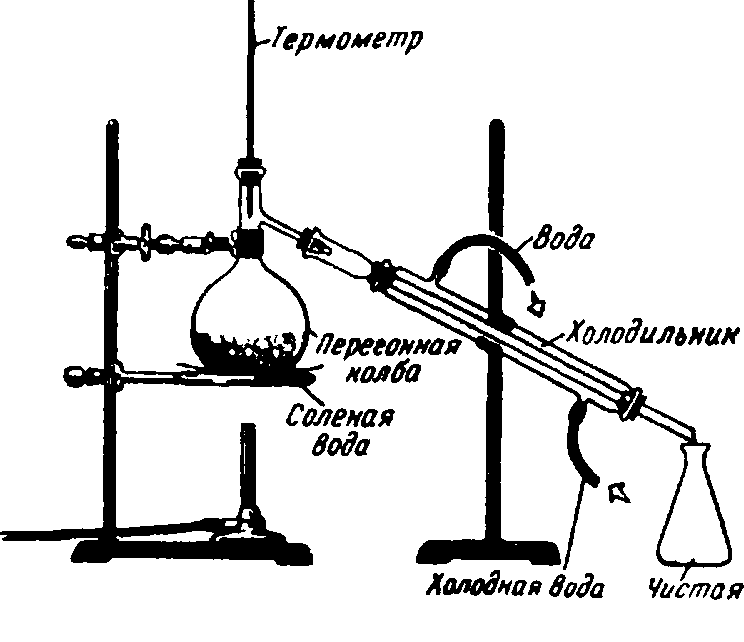
Операции разделения, например перегонка или вымораживание, не приводят к выделению компонентов соли.
Состав соли, выраженный соотношением чисел атомов натрия и хлора или соотношением весов этих атомов, является постоянным и соответствует формуле NaCl.
Хлористый натрий, как и вода, представляет собой чистое вещество.
С другой стороны, такие операции, как перегонка или вымораживание, обычно приводят к выделению из раствора чистых веществ, находившихся в растворе.
Чем ближе по свойствам компоненты, тем труднее выделить их из раствора.
Но даже в трудных случаях с помощью различных методов обычно можно осуществить разделение.
В природе растворы встречаются гораздо чаще, чем чистые вещества, а гетерогенные системы — чаще, чем растворы.
Чистые вещества часто приходится получать из растворов, используя соответствующие фазовые переходы.
Всем нам хорошо известны жидкие растворы. Но существуют также газообразные и твердые растворы.
Состав раствора
Это компоненты раствора которые являются чистыми веществами, они при смешении образуют раствор.
Если раствор двухкомпонентный, то один из компонентов называется растворителем, а другой — растворенным веществом.
Эти термины приняты просто для удобства. Поскольку для получения раствора необходимо смешать оба компонента, между ними нельзя провести четкого разграничения.
Когда приготовляют раствор из чистой жидкости и твердого вещества, жидкий компонент обычно называют растворителем.
Чтобы выразить состав раствора, мы должны указать относительные количества и природу компонентов. Эти относительные количества называются концентрациями.
Концентрации можно выражать по-разному. Мы рассмотрим здесь один из способов выражения концентрации.
Молярная концентрация
Химики часто выражают концентрацию твердого вещества в водном растворе числом молей этого вещества в 1 л раствора.
Это так называемая молярная концентрация.
Одно молярный (1М) раствор содержит 1 моль растворенного вещества в 1 л раствора, двух молярный (2М) — 2 моля растворенного вещества в 1 л и деци молярный (0,1М ) — 0,1 моля растворенного вещества в 1 л раствора.
Заметьте, что концентрация воды не указывается, хотя для приготовления раствора необходимо добавлять определенное количество воды.
Пример определения состава раствора
1 М раствор хлористого натрия мы можем приготовить следующим образом. По формуле (NaCl) легко рассчитать, что 1 моль весит 58,5 г (23,0 г + 35,5 г).
Эту соль мы растворяем в воде, налитой в мерную колбу емкостью 1 л, и затем добавляем воду до метки, соответствующей 1 л.
Точно так же 1 М раствор NaCl можно приготовить в мерной колбе емкостью 100 мл. В этом случае конечный объем раствора будет равен 0,1 л.
Мы должны взять 0,1 моля (5,85 г) соли, растворить ее в воде в мерной колбе и довести объем раствора до метки, соответствующей 100 мл.
Растворимость
Это когда определенное (твердое) вещество при внесении в жидкость начинает растворяться. При этом концентрация раствора увеличивается.
После того как растворится все твердое вещество, концентрация раствора становится постоянной и определяется относительными количествами растворенного вещества и растворителя.
Если теперь к раствору добавить еще некоторое количество твердого вещества, то его концентрация снова увеличится.
Однако наступает такой момент, когда при дальнейшем добавлении растворяемого вещества концентрация раствора уже не будет увеличиваться.
В результате растворения в определенном количестве жидкости всего твердого вещества, которое может в нем раствориться, достигается концентрация, соответствующая растворимости этого твердого вещества.
Раствор, находящийся в равновесии с избытком растворенного вещества, называется насыщенным.
Пример растворимости
Растворимость твердых веществ в жидкостях весьма различна. Например, хлористый натрий продолжает растворяться в воде при 20° С до тех пор, пока концентрация не станет равной примерно 6 М.
Это значит, что растворимость NaCl в воде при 20° С равна 6 моль/л. Растворимость NaCl в этиловом спирте при той же температуре составляет лишь 0,009 моль/л.
Даже для одной и той же жидкости растворимости различаются в широких пределах.
Так, растворимость хлористого кальция СаСl2 и азотнокислого серебра AgNO3 в воде превышает 1 моль/л. а растворимость хлористого серебра AgCl составляет лишь 10-5 моль/л.
Растворимые, слабо растворимые, нерастворимые растворы
Поскольку растворимость может изменяться в широких пределах, термин растворимый не имеет количественного смысла.
Даже наиболее растворимое твердое вещество имеет верхний предел растворимости, а наименее растворимое твердое вещество все же обладает некоторой растворимостью.
Если соединение имеет растворимость выше 0,1 моль/л, его обычно называют растворимым.
Если растворимость соединения ниже 0,1 моль/л, то такое соединение называют слабо растворимым.
Соединения с растворимостью ниже 10-3 моль/л называют очень слабо растворимыми.
Если же растворимость настолько мала, что практически соединения не растворяются, эти соединения называют нерастворимыми.
Чистую воду мы храним в стеклянной посуде, так как стекло практически нерастворимо в воде.
Свойства растворов
Хотя многие растворы бесцветны и по внешнему виду напоминают чистую воду, они очень сильно различаются по свойствам.
Это можно показать на пяти чистых веществах — хлористом натрии, иоде, сахаре, этиловом спирте и воде.
Этиловый спирт и вода при комнатной температуре — жидкости, остальные — твердые вещества. Познакомимся со свойствами растворов, которые образуют эти жидкости.
Сначала рассмотрим качественно растворимость твердых веществ в жидкостях. Добавляя небольшое количество каждого твердого вещества в 1 мл жидкости.
Мы легко обнаруживаем, что сахар растворяется в воде и в этиловом спирте, хлористый натрий хорошо растворяется в воде, но плохо — в этиловом спирте.
А иод плохо растворяется в воде, но хорошо — в этиловом спирте.
Таким образом, мы видим, что растворяющая способность двух выбранных нами растворителей весьма различна, по крайней мере по отношению к хлористому натрию, сахару и иоду.
Пример некоторых свойств раствора
В описанном выше опыте мы получаем четыре раствора, содержащих значительное количество растворенного вещества:
- I Сахар в воде
- II Сахар в этиловом спирте
- III Хлористый натрий в воде
- IV Иод в этиловом спирте
Раствор IV легко отличить от трех остальных. Этот раствор имеет темно-коричневую окраску, три других раствора бесцветны.
Их легко различить на вкус, но химики располагают более безопасными и надежными способами.
Эти растворы заметно различаются по способности проводить электрический ток.
Растворы сахара I и II имеют фактически такую же электропроводность, как и чистые растворители,— они практически не проводят ток.
Раствор III проводит ток намного лучше, чем чистая вода.
Итак, мы обнаружили большое разнообразие растворов, иод растворяется в этиловом спирте, окрашивая его в темно-коричневый цвет, но не растворяется в воде.
Хлористый натрий плохо растворяется в этиловом спирте, но хорошо — в воде; его водный раствор проводит электрический ток.
Сахар хорошо растворяется и в воде и в спирте, но оба раствора не проводят электрического тока. Эти различия весьма важны для химика.
Изменение электропроводности растворов имеет наиболее важное значение.
Что мы узнали о растворе?
Что такое раствор и растворитель?
Раствор – термодинамически устойчивая однородная система из двух или более компонентов, относительные количества которых могут изменяться в широких пределах.
Растворитель – компонент раствора который в чистом виде существует в таком же агрегатном состоянии, что и раствор.
Что такое раствор и из чего он состоит?
Раство́р — гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия. … Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора.
Для чего применяют растворы?
Раство́р (лека́рственная фо́рма) (лат. Solutio) — жидкая лекарственная форма, полученная растворением жидких, твёрдых или газообразных веществ в соответствующем растворителе. Растворы используют для внутреннего и наружного применения, а также для инъекций.
Какие существуют растворы?
Растворы бывают жидкие, твердые и газообразные. Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении.
В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Какие есть медицинские растворы?
- Медицинские растворы
- Вода для инъекций
- Реосорбилакт
- Рингера раствор
- Тивортин
- Убихинон композитум
- Метронидазол
- Латрен
- Нейроцитин
Статья на тему Растворы характеристика растворов


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.