Во время химических реакций происходит взаимное преобразование энергий – внутренней энергии вещества превращается в тепло, свет, электричество и движение, а также наоборот.
Экзотермические химические реакции характеризуются выделением энергии в окружающую среду в виде тепла, света или излучения.
Примером может служить горение спичек, в результате чего выделяется тепло и свет, а при распаде радия образуется тепло, свет и излучение.
Превращение энергии при химических реакциях: выделение и поглощение
Многие химические реакции, как, например, горение, соединение металлов с серой или хлором, нейтрализация кислот щелочами и др., сопровождаются выделением значительных количеств тепла.
Такие реакции, как разложение углекислого кальция, разложение окиси ртути и ряд других, наоборот, требуют непрерывного притока тепла извне и тотчас же приостанавливаются, если прекратить нагревание.
Очевидно, в этих случаях превращение происходит с поглощением тепла. При некоторых реакциях наряду с выделением тепла наблюдается также выделение света.
Тщательное изучение всевозможных химических процессов показало, что химическое превращение всегда связано с выделением или поглощением энергии.
Эти явления составляют существенную особенность химических превращений; для практики они часто даже важнее, чем происходящее в то же время образование новых веществ.
Поэтому мы рассмотрим выделение и поглощение энергии при химических реакциях несколько подробнее.
Выделение энергии в форме тепла при соединении различных веществ показывает, что эти вещества до соединения уже содержали в себе некоторый запас энергии, но только в скрытой форме.
Такая форма энергии, скрытой в веществах и «освобождающейся» только при химических превращениях, называется внутренней или химической энергией.
Образование энергии при соединении водорода с кислородом
Освобождение химической энергии связано с превращением ее в другие формы энергии.
Например, когда водород соединяется с кислородом, их химическая энергия превращается в тепловую и проявляется в виде выделяющегося при реакции тепла.
Понятно, что в образовавшейся воде уже нет того количества энергии, которое содержали водород и кислород вместе до их соединения. Но это отнюдь не значит, что в воде совсем не осталось химической энергии.
Вода, в свою очередь, может взаимодействовать с другими веществами с выделением тепла; следовательно, в ней еще имеется запас химической энергии.
Вообще при химических превращениях освобождается только часть содержащейся в веществах энергии; всей химической энергии мы не можем исчерпать и не знаем, как велик ее запас в различных веществах.
Измеряя тепловой эффект реакции, мы можем судить только об изменении этого запаса.
Выделением тепла сопровождаются очень многие химические реакции, так как легче всего химическая энергия переходит в тепловую. Значительно реже приходится наблюдать переход химической энергии в световую.
Обыкновенно в тех случаях, когда при реакции выделяется свет, химическая энергия превращается в световую не прямо, а через посредство тепловой энергии.
Например, появление света при горении угля является следствием сильного накаливания угля за счет выделяющегося при реакции тепла.
Такой же эффект можно получить, если нагреть уголь до высокой температуры чисто физическим путем, например, пропуская ток через угольную нить электрической лампочки.
Но известны и такие, правда, очень немногочисленные процессы, где химическая энергия превращается в световую непосредственно. Сюда относится свечение фосфора на воздухе, свечение гнилого дерева и т. п.
Во всех этих случаях выделение света происходит без сколько-нибудь заметного повышения температуры.
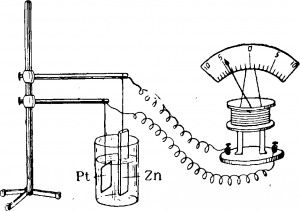
Переход химической энергии в электрическую
Химическая энергия может также превращаться в электрическую. Чтобы показать это на опыте, погрузим две пластинки— платиновую и цинковую — в стакан с разбавленной серной кислотой и соединим концы их проволоками с гальванометром (рис. 2).
Стрелка гальванометра тотчас же отклоняется, указывая на появление электрического тока. В то же время из жидкости выделяются пузырьки водорода, а цинк и серная кислота постепенно расходуются.
Следует заметить, что химическому превращению подвергаются только цинк и серная кислота, платина же остается неизмененной и служит лишь проводником электрического тока.
Таким образом, в этих условиях химическая энергия цинка и серной кислоты переходит в электрическую энергию. Изменяя условия, можно осуществить переход химической энергии в механическую.
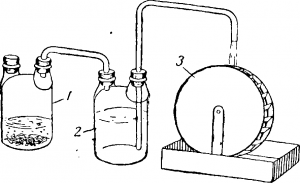
Это легко продемонстрировать при помощи установки, изображенной на рис. 3. В склянку налита серная кислота и помещено несколько кусочков цинка.
Выделяющийся при взаимодействии цинка с серной кислотой водород давит на воду, налитую в склянку 2, и заставляет ее подниматься по трубке вверх.
Химическая энергия цинка и серной кислоты превращается здесь в объемную энергию сжатого газа, а последняя — в потенциальную энергию поднятой воды.
Если под конец трубки подставить колесико с лопастями, то вытекающая из трубки вода будет приводить колесико в движение, совершая некоторую работу.
При разложении взрывчатых веществ химическая энергия тоже превращается в механическую — частью непосредственно, частью переходя сперва в тепловую энергию.
Итак, освобождающаяся при химических превращениях химическая энергия может переходить в тепловую, световую, электрическую и механическую энергию.
Но и обратно, все эти формы энергии могут превращаться в химическую.
Чаще всего происходит превращение тепловой энергии в химическую. Как известно, разложение многих веществ требует непрерывного нагревания.
Сообщаемое тепло поглощается при реакции и превращается в химическую энергию продуктов разложения.
Поэтому, например, ртуть и кислород, полученные путем разложения окиси ртути, содержат в сумме больше химической энергии, чем окись ртути, из которой они образовались.
Известны также и реакции соединения, сопровождающиеся поглощением тепла.
Например, получение азотной кислоты из воздуха основано на том, что при высокой температуре азот соединяется с кислородом, поглощая тепло и образуя окись азота NО, которая затем может быть превращена в азотную кислоту.
В данном случае сложное вещество — окись азота обладает большим запасом энергии, чем простые вещества — азот и кислород, из которых она образовалась.
Превращение электрической энергии в химическую
Превращение электрической энергии в химическую происходит при разложении веществ с помощью электрического тока.
Примером такого превращения может служить разложение воды электрическим током.
Подобным же путем в настоящее время получают многие металлы из их соединений, а также различные химические продукты: бертолетову соль, хлор, каустическую соду и др.
Очень важную роль в природе играет превращение световой энергии в химическую, сопровождающее процесс усвоения углекислого газа воздуха зелеными растениями.
Этот процесс, поддерживающий всю органическую жизнь на земле, требует непрерывного притока энергии извне.
Такой энергией является энергия солнечных лучей, которая поглощается растениями и превращается в скрытую химическую энергию образующихся в растениях веществ.
Разложение некоторых веществ на свету также сопровождается поглощением световой энергии и ее превращением в химическую.
Так, например, хлористое или бромистое серебро может неограниченно долго сохраняться в темноте, но при действии света постепенно распадается на свои составные части, причем серебро выделяется в виде мельчайших черных крупинок.
На этом основано применение хлористого и бромистого серебра в фотографии.
Так как выделение или поглощение энергии при химических реакциях чаще всего происходит в форме тепла, то все реакции, протекающие с выделением энергии, называются экзотермическими.
Реакции же, при которых, энергия поглощается, получили название эндотермических.
В соответствии с этим:
Химические соединения, образовавшиеся из простых веществ с выделением энергии, называются экзотермическими в отличие от эндотермических соединений, при образовании которых энергия поглощается.
Эндотермических соединений гораздо меньше, чем экзотермических.
Они содержат по сравнению с экзотермическими соединениями значительно больший запас энергии и сравнительно легко разлагаются. Tо более или менее неустойчивы.
Экзотермические соединения обычно образуются при низких или умеренных температурах, более устойчивы и гораздо труднее разлагаются, чем эндотермические соединения.
Из закона сохранения энергии непосредственно вытекает следующее положение:
Если при образовании какого-либо химического соединения из простых веществ выделяется (или поглощается) некоторое количество тепла, то при разложении этого соединения на простые вещества такое же количество тепла поглощается (или выделяется) .
Если бы при образовании сложного вещества выделялось больше тепла, чем его затрачивается на разложение того же вещества.
То, заставив сперва простые вещества соединиться, а затем, разложив образовавшееся соединение, мы получили бы некоторый излишек тепла из ничего, а этого по закону сохранения энергии не может быть.
Отсюда понятно, что чем больше тепла выделяется при образовании химического соединения, тем больше энергии надо затратить на его разложение.
Поэтому экзотермические соединения более прочны и труднее разлагаются, чем эндотермические.
Быстрые ответы?
Все химические реакции сопровождаются выделением или поглощением энергии. При разрыве химических связей в реагентах выделяется энергия, которая почти частично идёт на образование новых химических связей.
Либо выделяется в виде тепловой при проведении экзотермических реакций (например, горения топлива), либо преобразуется в электрическую в гальванических элементах и аккумуляторах.
Сначала химическая энергия топлива превращается в тепловую энергию рабочего тела (камера сгорания, паровой котёл), затем тепловая энергия преобразуется в механическую (турбина, поршневой двигатель) и лишь потом — в электрическую (электрический генератор).


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.