Получение аммиака это химический процесс в результате которого можно получить газообразный аммиак или аммиачную воду (нашатырный спирт).
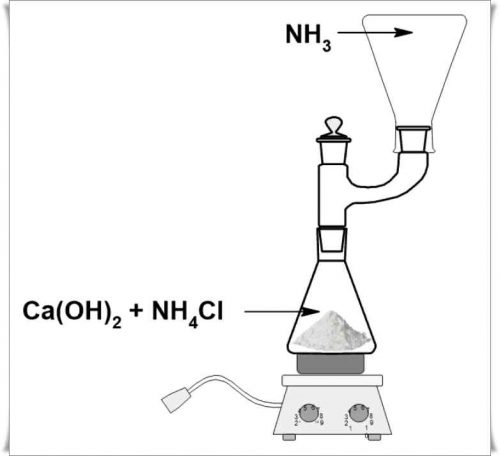
Для этого в лабораторных или производственных условиях используют безводный хлорид аммония NH4Cl или cульфат аммония (NH4)2SO4.
В результате образуется газообразный аммиак NH3.
Существуют четыре основных способа получения аммиака NH3:
- Получение из его солей (например хлорид аммония и cульфат аммония).
- Получение при коксовании каменного угля.
- Синтез аммиака из водорода и азота.
- Цианамидный.
Получение аммиака: способы и процесс
До конца позапрошлого столетия аммиак получался в промышленном масштабе исключительно как побочный продукт при коксовании каменного угля.
Каменный уголь содержит от 1 до 2% азота.
При сухой перегонке угля почти весь этот азот выделяется в виде аммиака и аммониевых солей.
Отделение аммиака и солей аммония от других газообразных продуктов сухой перегонки достигается пропусканием коксового газа через воду.
Из этой аммиачной или, как ее называют, газовой воды аммиак выделяется при нагревании с известью.
Полученный аммиак пропускают в серную кислоту, с которой он образует сульфат аммония (NH4)2SO4.
Для получения чистого аммиака сульфат аммония нагревают с известью.
Долгое время газовая вода служила единственным источником получения аммиака.
Но в начале XX в. были открыты совершенно новые способы технического получения аммиака, основанные на связывании или, как говорят, фиксации атмосферного у азота.
Цианамидный способ получения аммиака
Первым по времени открытия (1904 г.) является цианамидный способ получения аммиака, основанный на способности азота непосредственно соединяться с карбидом кальция СаС2.
Карбид кальция получается накаливанием смеси негашеной извести с углем в электрической печи.
При высокой температуре карбид, кальция взаимодействует с азотом, образуя твердое вещество, так называемый цианамид кальция CaCN2 и свободный углерод.
Реакция идет по уравнению:
CaО2 + N2= CaCN2 + С + 72 ккал
Для осуществления реакции пропускают струю азота через нагретый в одном каком-нибудь месте карбид кальция.
В месте нагрева начинается связывание азота, сопровождающееся выделением большого количества тепла.
Это тепло нагревает окружающую массу карбида, и процесс связывания азота идет до тех пор, пока весь карбид не соединится с азотом.
Полученный таким образом цианамид кальция представляет собой порошкообразное вещество, окрашенное в темносерый цвет примесью угля.
При действии на него нагретого до 110—115° водяного пара под давлением около 6 атмосфер цианамид кальция легко разлагается с образованием аммиака и карбоната кальция:
CaCN2 + 3Н2О = СаСО3 + 2NH3 + 18 ккал
Первый завод для получения цианамида кальция мощностью 4 тыс. т в год был построен в 1906 г. в Италии.
В 1921 г. мировое производство цианамида кальция достигло 500 тыс. г в год.
Но затем строительство новых заводов почти прекратилось, так как преобладающее развитие получил другой метод технического получения аммиака — синтез аммиака из водорода и азота.
Синтез аммиака из водорода и азота
При обыкновенной температуре азот не соединяется с водородом. Но уже давно было известно, что если пропускать через смесь этих газов электрические искры, то образуется некоторое количество аммиака.
Подробное изучение этой реакции показало, что пропускание искр вызывает не только образование аммиака, но и обратное разложение его на азот и водород.
Таким образом, реакция между азотом и водородом обратима и приводит к состоянию равновесия:
N2 + 3H2 ⇄ 2NH3
При высокой температуре, создаваемой электрическими искрами, равновесие сильно сдвинуто влево, вследствие чего количество получающегося аммиака очень мало.
Все попытки увеличить его долгое время кончались неудачей.
Только в начале нынешнего столетия после долгой и упорной работы удалось, наконец, найти условия, при которых выход аммиака становится достаточным для проведения процесса в заводском масштабе.
Одним из главных условий успешного проведения процесса оказалось высокое давление.
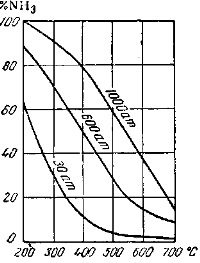
Рис. 2 Наглядно показывает, как изменяются количества аммиака при равновесии в зависимости от температуры и давления.
Действительно, из приведенного выше уравнения видно, что при образовании аммиака происходит уменьшение объема смеси азота с водородом.
Поэтому, согласно принципу Ле-Шателье, увеличение давления должно благоприятствовать образованию аммиака, что и подтвердилось на опыте.
С другой стороны, выяснилось, что реакция соединения азота с водородом сопровождается выделением тепла:
N2 + 3Н2 ⇄ 2NH3 + 22 ккал
Следовательно, чем выше температура, тем меньше будет получаться аммиака.
Поэтому реакцию надо вести при возможно низкой температуре.
Но при низких температурах скорость реакции настолько мала, что потребовалось бы слишком много времени для получения определенного количества аммиака.
Для ускорения процесса получения аммиака NH3 удалось добиться путем применения катализаторов.
Из различных металлов и их окислов наиболее подходящим катализатором оказалось металлическое железо (в виде губчатой массы) с незначительными добавками соединений алюминия и калия.
На практике реакцию ведут при температуре около 500°, компенсируя вызываемый этим сдвиг равновесия влево большим давлением.
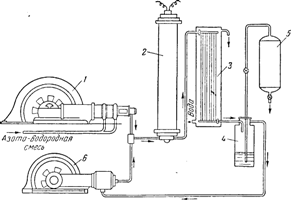
Рис. 3. Схема установки для синтеза аммиака.
Рассматривая изображенные на рисунке кривые, нетрудно убедиться, что один и тот же выход аммиака может быть получен как при низкой, так и при более высокой температуре, если соответственно увеличить давление.
Схема заводской установки для синтеза аммиака изображена на рис. 3.
Установка для получения аммиака
Смесь, состоящая из одного объема азота и трех объемов водорода, сжимается при помощи компрессора до 200—300 ат (в некоторых установках до 1000 ат).
И пройдя через фильтр для очистки газов (на схеме не показан), поступает в колонну синтеза 2, содержащую катализатор, где и происходит реакция образования аммиака.
Перед пуском всей системы в ход колонну синтеза нагревают изнутри током до 500—550°.
Эта температура затем поддерживается сама собой за счет выделяющегося при реакции тепла.
После прохождения над катализатором газы, содержащие уже до 20% аммиака, поступают в холодильник 3, где газообразный аммиак благодаря высокому давлению сжижается.
Жидкий аммиак отделяется затем от непрореагировавших азота и водорода в сепараторе 4.
Из сепаратора аммиак периодически переводится в сборник низкого давления 5, откуда его направляют в хранилище.
Непрореагировавшие газы засасываются из сепаратора циркуляционным насосом 6, смешиваются с новой порцией азото-водородной смеси, подаваемой компрессором 1, и опять попадают в колонну синтеза 2.
Таким образом, в системе непрерывно циркулирует определенное количество азото-водородной смеси.
В промышленности используются различные типы установок для синтеза аммиака, отличающиеся друг от друга способами приготовления азото-водородной смеси, конструкцией аппаратуры, составом катализаторов, величиной применяемого давления и т. п.
В настоящее время синтез аммиака является основным способом связывания атмосферного азота. Главное преимущество этого способа перед другими — сравнительная дешевизна производства.
Роль азота в жизненных процессах
Чтобы оценить, какое огромное значение для человечества имели эти открытия, нужно предварительно ясно представить себе роль азота в жизненных процессах.
Как мы уже говорили, при получении аммиака азот является обязательной составной частью белковых веществ я в качестве таковой необходим для питания всякого живого существа.
Однако, несмотря на огромные практически неисчерпаемые запасы свободного азота в атмосфере, ни животные, ни растения (за небольшими исключениями) не могут непосредственно воспользоваться этим азотом для питания.
Растения вберут азот из почвы, где он содержится главным образом в виде различных органических соединений, которые постепенно превращаются в соли азотной кислоты и соли аммония.
Растворяясь в почвенной воле, эти сопи всасываются корнями растений, а затем перерабатываются в их клетках в белки и другие сложные азотные соединения.
Животные не могут усваивать азот даже я в виде солей.
Для питания им необходимы белковые вещества, вырабатываемые растениями или другими животными.
Никакими иными соединениями белковые вещества не могут быть заменены.
Поэтому существование животных находится в полной зависимости от растений; только при посредстве растений они могут получать необходимый им азот.
Почва обыкновенно содержит очень незначительные количества азота, который все время извлекается из нее растениями.
При уборке с полей урожая уносится и извлеченный растениями из почвы азот. Таким образом, почва быстро истощается и становятся все менее и менее плодородной.
Поэтому для получения хороших урожаев необходимо постоянно пополнять убыль азота в почве путем введения в нее азотных соединений в виде различных удобрений.
До начала первой мировой войны 1914—1918 гг. глазным азотным удобрением служила натриевая (чилийская) селитра, ввозившаяся в Европу из Южной Америки.
Она же являлась единственным видом сырья для получения азотной кислоты, необходимой в производстве взрывчатых веществ и других соединений азота.
Ограниченность запасов природной селитры, их отдаленность от основных потребителей, а главным образом стремление освободиться от ввоза сырья, выдвинули перед химической промышленностью многих стран задачу использования атмосферного азота для получения азотных соединений.
Успешное решение этой задачи явилось одним из крупнейших завоеваний химии начала XX в.
В течение одного десятилетия были открыты не один, а даже несколько технических способов «связывания» азота воздуха.
Быстрые ответы?
В лабораторных (домашних) условиях газообразный аммиак получают нагреванием солей аммония в перевернутом закрытом сосуде, его присутствие определяют по характерному запаху.
В природе образуется в результате разложения азот содержащих органических веществ.
Для этого нужно добавить водород N2 + 3H2 ⇄ 2NH3, в присутствии катализаторов, давлении и соответствующей температуре.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.