Непредельные углеводороды это органические сложные вещества с открытой цепью, в молекулах которых между атомами углерода имеются двойные или тройные связи.
Примерами таких углеводородов можно считать этилен, полимер этилена, полиэтиленом и другие.
Что такое непредельные углеводороды
Непредельными, или ненасыщенными, или алкенами, или олефинами, называются органические соединения, в которых имеются кратные (двойные или тройные связи).
Важнейшими из них являются:
- Этиленовые (с одной двойной связью).
- Диеновые (с двумя двойными связями).
- Ацетиленовые (с одной тройной связью).
В соединениях с двойной связью атом углерода имеет 3 одинаковых σ-связи, которые образуются из:
- Одного s-электрона.
- И двух р-электронов (sp—гибридизация).
- А третьи р-электроны обоих атомов углерода, облачка которых имеют форму гантелей или восьмерок, при перекрывании в двух местах образуют π-связь.
Эти электроны называются π-электронами.
Таким образом, двойная связь состоит из одной σ-связи и одной π-связи, которая менее прочная, легко разрывается, поэтому олефины более реакционно способные, чем парафины.
Тройная связь у ацетилена состоит из одной σ-связи и двух π-связей.
Так как атом углерода имеет две одинаковый π -связи, в образовании которых участвуют один s -электрон и один р—электрон, то здесь происходит sp—гибридизация.
Названия олефиновых углеводородов происходит от соответствующих парафиновых углеводородов с окончанием — ен и указанием номера атома углерода, возле которого начинается двойная связь: этен (этилен), пропен (пропилен), бутен-1 (бутилен-1), пентен-2 (амилен-2) и др.
Как и алканы, низшие алкены — газы, а высшие — жидкости и даже твердые вещества.
Олефины очень реакционноспособны.
Они реагируют:
2СН2 = СН2 + О2 → 2СН3СНО,
СН2 = СН2 + Сl2 → СН2Сl — СН2Сl,
СН2 = СН2 + Н2О ⇄ СН3СН2ОН,
СН3 — СН = СН2 + HCI → СН3 — СНСl — СН3
СН2 = СН2 + H2SO4 ⇄ CH3CH2OSO3H,
nCH2 = CH2 → (- CH2 — CH2 -)n.
В случае присоединения к олефину соединений, которые содержат водород, последний присоединяется к тому атому углерода, который содержит больше водорода.
Это правило называется правилом Марковникова.
Этилен
Этилен — это бесцветный газ со слабым запахом, хорошо растворим в органических растворителях.
Взаимодействует с галогенами, галогеноводородами, кислородом, водой, серной кислотой и др.
Получают:
а) в лаборатории:
С2Н5ОН (H2SO4 160° С) → C2Н4 + H2O,
СН3СН2Сl + NaOH (С2Н5ОН кат.) → С2Н4 + NaCI + Н2O.
б) в промышленности:
С2Н6 → С2Н4 + Н2.
Применяется как сырье для получения дихлорэтана, этилового спирта, полиэтилена и др.
Простейшими представителями их являются этилен и ацетилен:
На воздухе он горит слегка светящим пламенем. Сжигаемый в специальных горелках, он служит для получения высоких температур.
Этилен является весьма важным сырьем для получения ряда синтетических продуктов.
Применение этилена основано на его высокой химической активности, выражающейся в способности к реакциям присоединения.
Двойная связь в молекулах этилена при действии различных веществ довольно легко разрывается, остается простая связь.
А за счет освободившихся валентностей происходит присоединение новых атомов или атомных групп.
Так, например, этилен легко присоединяет бром по месту двойной связи, переходя в насыщенное соединение дибромэтан С2Н4Вr:
Реакции присоединения характерны для всех углеводородов, имеющих двойные и тройные связи в молекулах.
Молекулы этилена обладают свойством не только присоединять к себе другие атомы или группы атомов, но и соединяться с себе подобными.
Такой процесс происходит, например, если сильно сжать этилен (выше 1000 ат) и нагреть до 200°.
В этих условиях молекулы этилена соединяются друг с другом, как это показано на следующей схеме:
СН2=СН2=СН2=СН2+СН2=СН2+ … → [—СН2—СН2—+—СН2—СН2—+—СН2—СН2—+…] → —СН2—СН2—СН2—СН2—СН2—СН2— …
Реакцию можно представить как результат раскрытия двойных связей в большом числе молекул этилена.
И последующего соединения образовавшихся частиц со свободными валентностями (двухвалентных радикалов) в одну гигантскую молекулу.
Реакция соединения нескольких молекул в одну большую, происходящая только за счет соединения по месту двойных или тройных связей, называется полимеризацией, а продукт этой реакции — полимером.
Полиэтилен
Полимер этилена называется полиэтиленом. Это белое твердое вещество, стойкое к действию концентрированных кислот и щелочей.
Полиэтилен обладает высокими механическими и электроизоляционными свойствами, что позволяет широко использовать его в электро- и радиопромышленности.
А также для изготовления труб, листовых материалов, различных изделий технического и бытового назначения.
Пленки из полиэтилена отличаются исключительной газо- и влагонепроницаемостью.
Реакции полимеризации различных соединений, содержащих кратные связи, широко применяются в химической промышленности для получения разнообразных синтетических продуктов — пластических масс, химических волокон, синтетических каучуков и т. д.
Этилен является первым членом ряда этиленовых углеводородов, или олефинов. Следующие члены этого ряда — пропилен С3Н6, бутилен С4Н8 и т. д.
Главным источником получения этилена и его гомологов служат газы крекинга нефтяных продуктов.
Крекинг
Крекингом называют процесс расщепления больших молекул углеводородов на мелкие молекулы, проходящий при нагревании предельных углеводородов до 400—500° при повышенном давлении.
Например:
СН3—СН2—СН2—СН3 → СН2=СН2 + СН3—СН3
Крекинг нефтяных продуктов позволяет получать низко-кипящие углеводороды (например, бензин) из углеводородов с высокой температурой кипения.
При крекинге наряду с предельными углеводородами всегда получаются и непредельные.
Непредельные углеводороды, образующиеся при крекинге, а также в значительных количествах содержащиеся в попутных газах нефтедобычи.
Находят все более широкое использование в промышленности органического синтеза в качестве сырья для производства пластических масс, химических волокон, синтетических спиртов, различных каучукоподобных материалов, моющих средств, растворителей и других ценных продуктов.
Весьма важным непредельным углеводородом, молекулы которого содержат большое число двойных связей, является каучук.
Каучук
Состав молекулы каучука может быть выражен формулой (C5H8)х, где величина х составляет от 1000 до 3000.
Каучук является полимером углеводорода изопрена:
Как видно из этой схемы, при полимеризации изопрена происходит перемещение двойной связи.
Каучук содержится в млечном соке некоторых растений.
Другой природный продукт — гуттаперча также является полимером изопрена, но с иной конфигурацией молекул.
Сырой каучук липок, недостаточно прочен, а при небольшом понижении температуры становится хрупким.
Чтобы придать изготовленным из каучука изделиям необходимую прочность и эластичность, проводят вулканизацию (нагревание с серой). Вулканизованный каучук называется резиной.
Отсутствие в нашей стране природного каучука вызвало необходимость в разработке метода искусственного получения этого важнейшего для народного хозяйства материала.
Советскими химиками был найден и впервые в мире осуществлен в промышленном масштабе способ получения синтетического каучука.
По способу, предложенному Сергеем Васильевичем Лебедевым (1874—1934), исходным материалом для производства синтетического каучука служит непредельный углеводород бутадиен СН2 = СН—СН = СН2, который получается из спирта, а также из нефтяного бутана.
Полимеризация бутадиена приводит к образованию синтетического бутадиенового каучука:
хСН2=СН—СН=СН2 → [—СН2—СН=СН—СН2—х ]
бутадиен синтетический, каучук
В настоящее время наша промышленность производит много различных видов синтетических каучуков, превосходящих по некоторым свойствам природный каучук.
Ацетилен
Ацетилен С2Н2. Наиболее важным из углеводородов, в молекулах которых имеется тройная связь, является ацетилен Н—С ≡ С—Н, представляющий собой бесцветный газ.
Ацетилен получают действием воды на карбид кальция:
СаС2 + 2Н2O = Са (ОН)2 + С2Н2
а также крекингом в определенных условиях метана и других предельных углеводородов.
Так как ацетилен принадлежит к числу эндотермических соединений, при его горении выделяется большое количество тепла.
Это позволяет использовать ацетилен для автогенной сварки металлов.
Ацетилен вступает в разнообразные реакции — присоединения, полимеризации и другие.
На основе использования ацетилена в качестве исходного сырья в настоящее время широко развернуты промышленные синтезы таких важнейших продуктов, как уксусная кислота, синтетический каучук, пластмассы, различные растворители и пр.
В области непредельных, а особенно ацетиленовых углеводородов, большое теоретическое и практическое значение имеют исследования, проведенные Алексеем Евграфовичем Фаворским (1860—1945) и его учениками.
Фаворский открыл большое число различных группировок молекул при химических реакциях и показал, как можно управлять этими процессами.



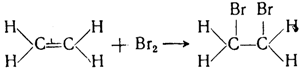

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.