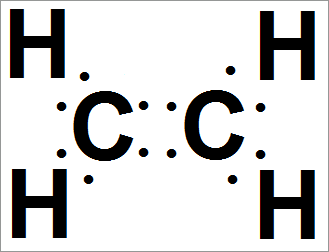
Этилен углеродная двойная связь
Этилен — простое соединение углерода с водородом, имеющее формулу С2Н4. В молекуле этилена на два атома водорода меньше, чем в молекуле этана С2Н6.
Это означает, что при написании структурной формулы этилена мы должны принять во внимание то, что два электрона не образуют связь С—Н.
Допустим, мы написали электронную формулу только с одинарной связью:
В этой формуле имеются два необобщенных электрона, что свидетельствует о неиспользованной возможности к образованию химической связи.
Такая нежелательная ситуация легко может быть исправлена путем обобщения этих электронов в пару.
При этом образуется дополнительная связь.
Теперь атомы углерода так же, как атомы кислорода в молекуле О2, связаны двойной связью:
Реакционная способность этилена
В этане С2Н6 все связи являются обычными одинарными связями. Опыты показывают, что этан — довольно неактивное вещество.
Он вступает в реакции только с очень реакционно-способными веществами (например, со свободными атомами хлора) или при переходе в возбужденное энергетическое состояние в результате нагревания (например, при горении).
С другой стороны, этилен легко реагирует с многими химическими веществами.
Имея четыре электрона, образующих углерод-углеродную связь, этилен может быть атакован по электронам двойной связи.
Известно, что типичными реакциями этилена являются реакции с веществами, которые имеют недостаток электронов.
К таким веществам относятся, например, окислители, поэтому мы можем ожидать, что двойная связь будет легко окисляться.
Этилен восстанавливает такие окислители (т. е. окисляется такими окислителями), как перманганат калия или бихромат калия при обыкновенных температурах.
В таких же мягких условиях этан совсем не реагирует с этими веществами.
Геометрические особенности этилена
Форма молекулы этилена изучалась с помощью различных методов. Этилен — плоская молекула:
Все четыре атома водорода и два атома углерода лежат в одной плоскости.
Этот экспериментальный факт свидетельствует о том, что в этилене имеется жесткая двойная связь, которая препятствует свободному вращению одной на групп СН2 относительно другой.
Вращение одной группы СН2 относительно другой (вокруг С = С связи как оси) должно быть энергетически ограничено, иначе молекула не сохранит своей плоской формы.
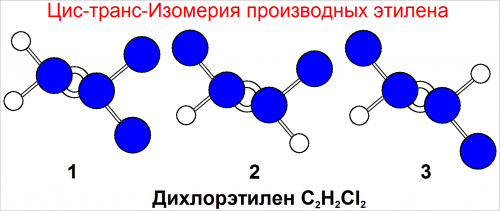
цис-транс-Изомерия производных этилена
В молекуле этилена атомы водорода могут замещаться атомами галогенов. Например, одно из таких соединений имеет формулу С2Н2Сl2.
При синтезе обнаружили, что могут быть получены три различных чистых вещества с одной и той же формулой С2Н2Сl2.
Различные соединения, имеющие одинаковую молекулярную формулу, называются изомерами.
Существование трех изомеров С2Н2Сl2 легко объясняется на основе геометрии молекул.
Три возможные структуры с этой формулой показаны на рис. 1. Все они называются дихлорэтиленом.
Существуют два типа изомеров. Формула (рис. 1-1) отличается от формул (рис. 1-2) и (рис. 1-3). В формуле (рис. 1-1) оба атома хлора присоединены к одному и тому же атому углерода.
В формулах (рис. 1-2) и (рис. 1-3) каждый атом хлора присоединен к разным атомам углерода.
Различие между соединением (рис. 1-1) и двумя другими соединениями — (рис. 1-2) и (рис. 1-3) — подчеркивается тем, что молекулы (рис. 1-2) и (рис. 1-3) называют структурными изомерами.
Отличии изомеров
Чем же отличаются друг от друга изомеры (рис. 1-2) и (рис. 1-3)?
Хотя в обоих изомерах к каждому атому углерода присоединено по одному атому хлора, в соединении (60) они расположены по «одну сторону» от двойной связи.
Такое соединение называется цис—изомером. В соединении (рис. 1-3) атомы хлора расположены друг против друга.
Такое соединение называется тронс-изомером. Формулы (рис. 1-2) и (рис. 1-3) соответствуют цис— и транс—изомерам дихлорэтилена.
Опыты показывают, что изомер (59) очень трудно превратить в изомер (рис. 1-2) или (рис. 1-3). Для этого необходимо, чтобы разрушились одни связи и образовались другие.
Такие реакции в большинстве случаев протекают очень медленно, так как энергии активации должны быть почти равны энергиям разрушаемых связей.
Напротив, превращение изомера (рис. 1-2) в (рис. 1-3) или обратное превращение можно осуществить просто нагреванием вещества.
Связи не должны разрушаться полностью — необходимо лишь вращение вокруг углерод-углеродной двойной связи.
Этот процесс имеет гораздо более низкую энергию активации, и реакция протекает при умеренных температурах