Изотопы нерадиоактивных элементов
Возможность существования изотопов вытекает как следствие из теории распада радиоактивных элементов. Но так как большинство радиоактивных элементов получено в совершенно ничтожных, «невесомых» количествах, то атомные веса изотопов были вычислены только на основании закона радиоактивного распада и не могли быть проверены непосредственными измерениями.
Изотоп
Однако вскоре нашлось реальное доказательство существования изотопов. Как мы уже говорили, конечным продуктов распада урана и тория является свинец. Но свинец, образующийся:
из урана, должен иметь атомный вес 206, а свинец из тория 208. Между тем атомный вес обыкновенного свинца 207,2. Это обстоятельство побудило исследовать свинец, постоянно содержащийся в урановых и ториевых рудах. После многократных и тщательных определений атомного веса уранового свинца было, наконец, установлено, что его атомный вес 206,1; атомный вес ториевого свинца оказался равным 207,97. Таким образом, оба изотопа свинца были найдены в природе. По всем химическим свойствам, кроме атомного веса, они совершенно тождественны с обыкновенным свинцом и между собой. Обыкновенный же свинец представляет в основном смесь двух указанных выше изотопов.
После открытия изотопов свинца естественно возникла мысль, не являются ли и другие элементы плеядами изотопов. Окончательное разрешение этот вопрос получил в 1922 г., когда английский физик Астон разработал своеобразный метод определения атомных весов, основанный на анализе каналовых лучей.
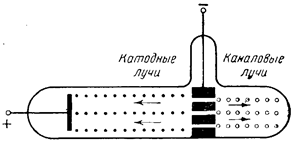
Каналовые лучи возникают в катодной трубке, если катод ее помещается посредине и снабжен отверстиями («каналами»). При пропускании тока из этих отверстий выходят пучки невидимых .лучей, направленных в сторону, противоположную катодным лучам (рис. 53) и состоящих из положительно заряженных частиц. Частицы каналовых лучей представляют собой не что иное, как потерявшие один или несколько электронов атомы или молекулы тех веществ, из которых состоит газ в трубке.
Воспользовавшись свойством каналовых лучей отклоняться в магнитном и электрическом полях, Астон сконструировал прибор, позволяющий определять присутствие изотопов в различных простых веществах. Этот прибор получил название масс-спектрографа.
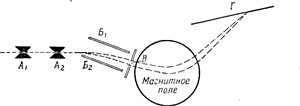
Схема масс-спектрографа изображена на рис. 54. Каналовые лучи проходят сквозь две узкие параллельные щели А1 и Л2 и в виде тонкого пучка попадают в электрическое поле между двумя пластинками конденсатора Б и Б2. Здесь лучи расходятся, так как положительно заряженные частицы в зависимости от их массы, заряда и скорости различно отклоняются заряженными пластинками конденсатора. Часть развернутого пучка выделяется щелью В и попадает в магнитное поле, направление которого таково, что пучок делается сходящимся. Если все частицы имеют одинаковую массу и заряд и различаются только скоростью, то сходящиеся лучи образуют на фотографической пластинке Г отчетливую черную линию, если же в пучке присутствуют частицы с различными массами, то на пластинке получается ряд линий, из которых каждая соответствует частицам определенной массы (рис. 55).
Астон назвал эту систему линий массовым спектром. Зная положение линий для какого-нибудь определенного вещества, можно по сравнению с ним определить массы, соответствующие другим линиям.
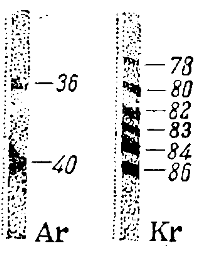
Пользуясь своим прибором, Астон приступил к исследованию различных элементов. Эти исследования показали, что многие простые вещества представляют собой смеси изотопов. Так, например, обыкновенный хлор состоит из двух изотопов с атомными весами 35 и 37, медь — тоже из двух изотопов с атомными весами 63 и 65; магний — из трех изотопов с атомными весами 24, 25 и 26 и т. д. Таким образом, прежнее представление об абсолютной тождественности всех атомов одного и того же элемента было разрушено.
Оказал ось, что многие простые вещества состоят из атомов различного веса и то, что мы называем атомным весом элемента, есть лишь некоторая средняя величина, средний вес атомов данного простого вещества. Замечательно, что атомные веса всех открытых изотопов, определенные с точностью до 0,001, оказались целыми числами. На этом основании Астон сделал следующее обобщение, которое он назвал правилом целых чисел: истинные атомные веса всех элементов числа целые. Все отклонения обычных атомных весов от целых чисел объясняются тем, что многие простые вещества являются смесями изотопов.
Для обозначения изотопов одной и той же плеяды пользуются обычными символами соответствующих элементов, добавляя к ним справа вверху индекс, указывающий атомный вес изотопа. Так, изотопы хлора обозначают через Сl35 и Сl37, изотопы магния — Mg24, Mg25 и Mg26 и т. д.
В настоящее время все химические элементы исследованы на содержание в них изотопов. Установлено, что большинство элементов является плеядами изотопов и лишь немногие совсем не содержат изотопов. Число изотопов в некоторых плеядах довольно велико; например, у кадмия и теллура их обнаружено по восьми, а у олова — десять. Общее число известных изотопов одних только нерадиоактивных элементов достигает 250; если же прибавить к этому числу изотопы радиоактивных элементов как существующих в природе, так и получаемых искусственным путем , то число открытых изотопов, т. е. известных нам видов атомов, превысит 400.
Так как химические свойства изотопов практически тождественны, то разделение изотопов является чрезвычайно трудной задачей. Все же благодаря использованию явлений, зависящих в основном от массы атомов, а не от их химических свойств, ока-залось возможным отчасти разложить некоторые простые вещества на изотопы. Так, например, в 1921 г. путем дробной перегонки были получены две фракции ртути, атомные веса которых, отличались на 0,189. В 1932 г. многократной диффузией из обычного неона выделены две почти чистые фракции Ne20 и Ne22, а в 1939 г. полностью разделены изотопы хлора. В настоящее время таким путем получено в чистом виде большое число изотопов различных элементов.
Выше мы говорили, что химические свойства изотопов практически тождественны. Это значит, что если и существует некоторое различие между изотопами в отношении их химических свойств, то оно так мало, что мы пока еще не можем его обнаружить. Исключение составляют открытые в 1932 г. изотопы водорода Н1 и Н2. Вследствие огромной относительной разницы их атомных весов (один изотоп тяжелее другого в два раза) свойства этих изотопов заметно неодинаковы. Поэтому их удалось, полностью отделить друг от друга химическим путем. Изотопу водорода с атомным весом 2 дано название дейтерий и присвоен специальный символ D. Дейтерий содержится в обыкновенном водороде в количестве около 0,017%. Известен также радиоактивный изотоп водорода Н3 — тритий (период полураспада около 12 лет), получаемый только искусственным путем: В природе тритий не обнаружен.
Соединение дейтерия с кислородом D2O называется «тяжелой водой» (см. стр. 220). Наряду с тяжелой водой получены также и многие другие соединения, в состав которых вместо обыкновенного водорода входит дейтерий; например, тяжелый аммиак ND3 тяжелый хлористый водород DCl и др.
Получение тяжелой воды, а также разделение изотопов многих элементов положило начало быстрому развитию новой области химии—химии изотопов.
Изотопные индикаторы- За последние десятилетия при изучении механизма химических и биологических процессов широко используются так называемые изотопные индикаторы или «меченые атомы». Применение их основано на том, что при химических превращениях можно проследить пути перехода интересующего нас элемента, изменив концентрацию одного из его изотопов в каком-либо из взятых для реакции веществ. Так как все изотопы одного и того же элемента ведут себя при химических реакциях практически тождественно, то по изменению изотопного состава данного элемента в тех или иных продуктах реакции можно проследить, куда именно он перешел.
Приведем два примера успешного решения при помощи нового метода спорных вопросов органической химии.
1) В органической химии долгие споры вызывал механизм реакции омыления (), для которого возможны две схемы, отличающиеся местами разрыва и образования связей. Например, для уксусноэтилового эфира:
Вопрос о том, какая из этих схем правильнее передает ход реакции, был просто и однозначно разрешен путем применения в реакции воды с повышенным содержанием тяжелого изотопа кислорода О18. Тяжелый изотоп кислорода (отмеченный на схемах звездочкой) должен перейти по схеме I в кислоту, а по схеме II — в спирт. Последняя схема оказалась исключенной, так как сжигание полученного спирта дало воду с нормальной плотностью, т. е. спирт не содержал тяжелого изотопа кислорода.
2) Применение при изучении процесса усвоения углекислого газа растениями тяжелого изотопа кислорода О18 (для опытов пользовались углекислым газом и водой, обогащенными О18) показало, что процесс идет по схемам:
Таким образом, было установлено, что возвращаемый растениями в атмосферу кислород целиком берется из воды, а не из углекислого газа.
Новый метод исследования нашел широкое применение, особенно после того, как был открыт и получен ряд изотопов радиоактивных элементов.
При исследовании элементов методом Астона вскоре обнаружилось, что наряду с атомами различного веса, образующими одну плеяду изотопов, встречаются также атомы одинакового веса, но принадлежащие к различным плеядам и, следовательно, имеющие различный заряд ядра. В качестве примера можно назвать: Аr40, K40 и Са40, Сr54 и Fe54, Cd112 и Sn112 и др. Атомы, имеющие одинаковый вес, но разные химические свойства, называются изобарами.
Существование изобаров особенно наглядно показывает, что масса атома еще не определяет его химических свойств и что основная величина, от которой зависят свойства атома, — это заряд его ядра.
Открытие явления изотопии потребовало пересмотра и самого-понятия «химический элемент». Как мы уже отмечали, понятие химический элемент в последнее время почти отождествлялось, с понятием атома. Считалось, что химических элементов существует столько же, сколько и различных, видов атомов. Но теперь с открытием изотопов число различных видов атомов возросло уже приблизительно до 250 (не считая изотопов радиоактивных элементов) и может увеличиться еще больше. Естественно возникает вопрос, рассматривать ли изотопы одной и той же плеяды как отдельные элементы или попрежнему считать их за один элемент. Многие соображения (тождество химических свойств изотопов, трудность их разделения и др.) говорят в пользу второго толкования. Поэтому международная комиссия по атомным весам еще в 1923 г. постановила считать, что химический элемент определяется атомным порядковым номером и может состоять как из одинаковых, так и из различных по весу атомов. Элементы, состоящие из одинаковых атомов, обычно называют-«чистыми», а состоящие из различных по весу атомов — «смешан-ными» элементами.
Таким образом, химический элемент есть вид атомов, характеризующийся определенной величиной положительного заряда, ядра.
Вы читаете, статья на тему Изотопы нерадиоактивных элементов

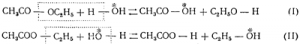
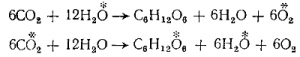
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.