При определении способности каждого атома второго периода к образованию химических связей мы подсчитывали число атомов водорода или число атомов фтора, с которым он может соединиться.
Так, атом кислорода соединяется с двумя атомами водорода, образуя воду Н2О. Поэтому говорят, что кислород двухвалентен.
Кислород образует две обобщенные пары электронов, по одной паре с каждым атомом водорода.
Каждая из этих обобщенных пар электронов образует одинарную связь.
Двойная вязь в молекуле кислорода
Молекула кислорода, которая, как показывают экспериментальные данные, имеет формулу О2.
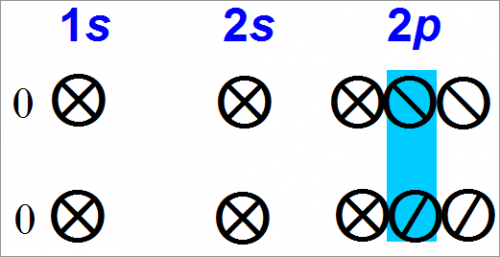
Рассмотрения одинарной связи между двумя атомами кислорода, что с помощью электронных орбит выражается следующим образом:
Видно, что у каждого атома кислорода сохраняется способность к дальнейшему образованию связи.
Например, каждый атом кислорода может реагировать с атомом водорода, образуя перекись водорода, как это было показано электронной формулой.
Каждый атом кислорода может реагировать с атомом фтора, образуя F2O2.
Для каждого атома кислорода необходим другой атом с электроном на валентной орбите, заполненной наполовину, потому, что он может реагировать как двухвалентный атом.
Образование двойной связи в молекуле кислорода
Предположим, что вблизи атома кислорода нет ни атома водорода, ни атома фтора.
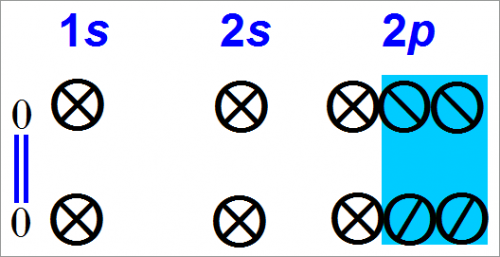
Тогда происходит следующее: между двумя атомами кислорода, уже связанными одной связью, образуется вторая связь.
Это можно представить с помощью электронных орбит:
Это предположение подтверждается многими фактами:
- Связь в молекуле кислорода прочнее, чем кислород-кислородная связь в перекиси водорода (для ее разрушения требуется большее количество энергии).
- Колебательная частота молекулы кислорода выше, чем у обычной одинарной связи, что подтверждает существование дополнительной связи.
- Длина связи в молекуле О2 равна 1,21 А. В молекуле газообразной перекиси водорода длина кислород-кислородной связи равна 1,48 Å.
- Меньшая длина связи в молекуле О2 показывает, что два атома кислорода связаны друг с другом более прочно, чем в перекиси водорода НООН, и используют дополнительные электроны для связи.
Поскольку все приведенные доказательства согласуются со схемой (рис. 3), связь в О2 называется двойной связью.
Электронная формула молекулы кислорода может быть представлена так:
Схема (выше) показывает, что обобщаются две пары электронов. Около каждого атома кислорода находится восемь электронов.
С одной стороны, молекула кислорода устойчива, так как каждый атом полностью использует свою способность к образованию связей.
С другой стороны, такое специфическое строение связей в молекуле кислорода, несомненно, обусловливает реакционную способность.