Теория:
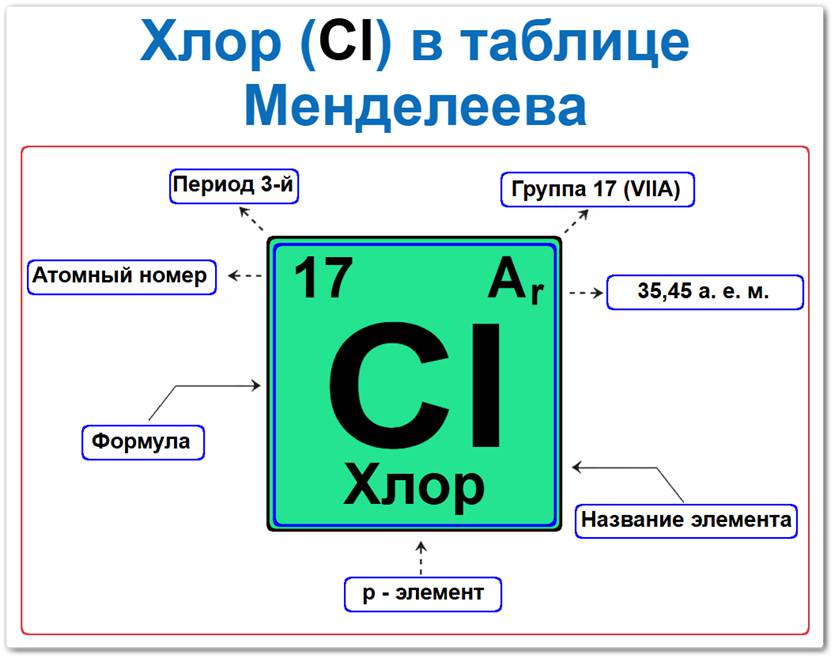
Хлор (Cl) в периодической системе: 3‑й период, 17‑я группа (по устаревшей классификации — VII A), атомная масса 35,45 а.е.м.
Занимает положение в 3‑м периоде, что определяет его принадлежность к активным неметаллам — галогенам.
Хлор в свободном виде представляет собой ядовитый газ желтовато-зеленого цвета с резким удушливым запахом.
В природе встречается только в виде соединений, самое известное из которых — поваренная соль (NaCl).
Будучи химическим элементом p-блока, он располагается в правой части таблицы Менделеева, находясь в группе галогенов вместе с фтором, бромом и иодом.
Нахождение Хлора в 17‑й группе и наличие семи электронов на внешнем уровне обуславливают его ключевые параметры:
Высокую электроотрицательность и переменную валентность от I до VII (в соединениях с кислородом).
А также широчайшее применение: от производства ПВХ-пластика для ваших окон до дезинфекции воды и отбеливания тканей.
Структура атома подтверждается его электронной формулой (конфигурацией):
1s2 2s2 2p6 3s2 3p5 (или [Ne] 3s2 3p5).
На которой наглядно можно определить его положение как p-блочного элемента, которому не хватает всего одного электрона до завершения стабильного электронного слоя.
Хлор элемент таблицы Менделеева который можно определить на основании закона периодичности: положение в ряду активных неметаллов период 3, группа 17, а также по его порядковому номеру (Z = 17).
Как определить положение Хлора в Таблице Менделеева
Локация хлора в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (17-я группа, галогены).
- Период (горизонтальный ряд).
- Электронное семейство (хлор — p‑элемент).
Порядковый номер / атомный номер (Z = 17)
- Служит уникальным кодом элемента в системе.
- В ядре — 17 протонов; в нейтральной оболочке — 17 электронов.
- Электронное строение: 2, 8, 7.
Важно: Для строителя хлор — это основа ПВХ. В справочнике 1934 года хлорорганические соединения только начинали активно изучаться для нужд промышленности, а сегодня без них невозможно представить современные стройматериалы.
Название и символ
- Название: «хлор» (от греч. chloros — «бледно-зеленый»).
- Символ: Cl.
- Примечание: Был открыт Карлом Шееле в 1774 году. Это один из самых агрессивных неметаллов.
Группа (17 / VII A)
Расположен в 17‑й группе. В периодической системе хлор находится в одной вертикальной колонке с фтором (выше) и бромом (ниже) относиться к галогенам.
Химический потенциал:
- Валентность хлора: переменная I, III, V, VII (в водородных соединениях — I).
- Степень окисления: от -1 (наиболее типичная) до +7. Является сильнейшим окислителем.
Период (3‑й)
Находится в 3‑м периоде — его электроны распределены по трем энергетическим уровням.
Влияние на свойства:
- Химическая активность: Очень высокая. Энергично реагирует почти со всеми металлами и многими неметаллами.
- Техническое значение: Используется для получения соляной кислоты, растворителей, средств защиты растений и пластических масс.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Cl) ≈ 35,45 а.е.м.
- Определение: Хлор — один из немногих элементов, чья атомная масса сильно отличается от целого числа из-за наличия двух стабильных изотопов (35Cl и 37Cl).
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Идет активное заполнение внешнего 3p‑подуровня (3p5).
Специфика блока: Как типичный неметалл, хлор имеет высокую энергию ионизации и стремится притянуть недостающий электрон для завершения октета.
Определение энергетических уровней Хлора по Таблице Менделеева
Положение Хлора (Cl) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 3-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Хлора 3 энергетических уровня.
2. Список «жильцов» (Распределение электронов)
Атомный номер Хлора — 17. Его 17 электронов распределены по уровням следующим образом:
Cl ) 2 ) 8 ) 7
3. 17-я группа (Химический характер)
Хлор — элемент главной подгруппы VII группы (или 17-й группы).
- p-элемент: Активный неметалл, галоген.
- Свойства: Высокая реакционная способность, выраженные неметаллические признаки.
Проверка знаний: Как определить хлор по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Хлор (Cl) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 17. Показывает заряд ядра и общее число электронов.
- 2) 3-й период, 17-я группа. Точные координаты в таблице.
- 3) p-элемент. Относится к семейству неметаллов-галогенов.
- 4) Ошибка. Щелочные металлы — это 1-я группа.
- 5) Ошибка. Хлор — активный и ядовитый газ с резким запахом.
- 6) Ошибка. Номер периода (3) указывает на наличие 3 уровней.
Часто задаваемые вопросы:
Хлор расположен в 3-м периоде, 17-й группе. Порядковый номер — 17.
У хлора 3 энергетических уровня.
Электронная схема: 2, 8, 7.
Хлор является p-элементом. В его атоме электронами заполняется внешний p-подуровень.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.