Теория:
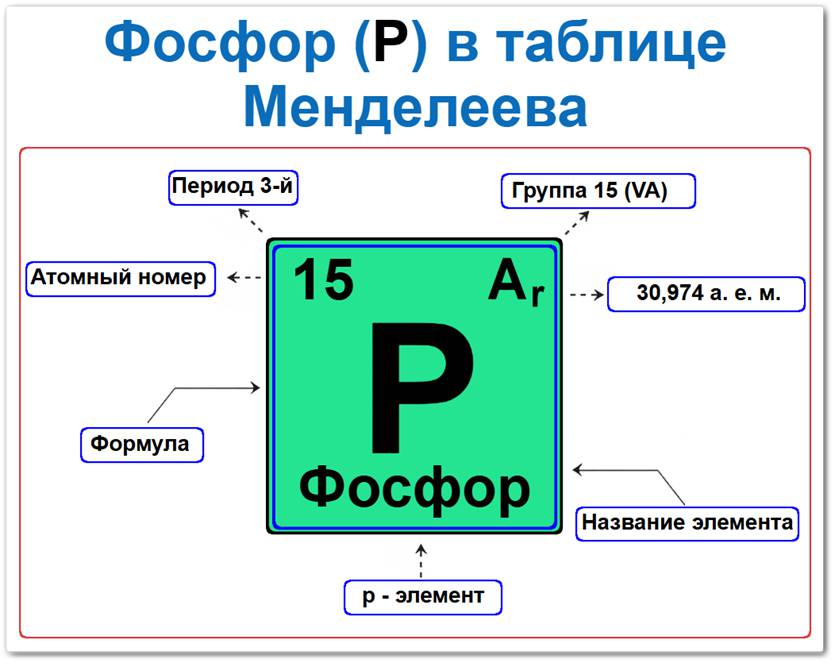
Фосфор (P) в периодической системе: 3‑й период, 15‑я группа (по устаревшей классификации — V A), атомная масса 30,9737 а.е.м.
Занимает положение в 3‑м периоде, что определяет его принадлежность к типичным неметаллам.
Фосфор не встречается в природе в свободном виде из-за своей высокой химической активности, он содержится в минералах группы апатитов и фосфоритов, а также в организме человека.
Будучи химическим элементом p-блока, он располагается в правой части таблицы Менделеева, находясь в одной подгруппе с азотом (сверху) и мышьяком (снизу).
Нахождение Фосфора в 15‑й группе и наличие пяти электронов на внешнем энергетическом уровне обуславливают его ключевые параметры:
Переменную валентность III и V.
А также явление аллотропии (белый, красный и черный фосфор), широкое применение в производстве удобрений, моющих средств, спичек и в металлургии как раскислитель меди.
Структура атома подтверждается его электронной формулой (конфигурацией):
1s2 2s2 2p6 3s2 3p3 (или [Ne] 3s2 3p3).
На которой наглядно можно определить его положение как p-блочного элемента, находящегося в середине заполнения 3p-подуровня.
Фосфор элемент таблицы Менделеева который можно определить на основании закона периодичности: положение в ряду неметаллов период 3, группа 15, а также по его порядковому номеру (Z = 15).
Как определить положение Фосфора в Таблице Менделеева
Локация фосфора в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (15-я группа, подгруппа азота).
- Период (горизонтальный ряд).
- Электронное семейство (фосфор — p‑элемент).
Порядковый номер / атомный номер (Z = 15)
- Служит уникальным кодом элемента в системе.
- В ядре — 15 протонов; в нейтральной оболочке — 15 электронов.
- Электронное строение: 2, 8, 5.
Важно: Как плотник, вы могли сталкиваться с фосфором в виде огнебиозащитных пропиток для дерева (антипиренов). Фосфаты в составе таких средств делают древесину трудновоспламеняемой.
Название и символ
- Название: «фосфор» (от греч. φωσφόρος — «светоносный»).
- Символ: P.
- Примечание: Элемент был открыт алхимиком Хеннигом Брандом в 1669 году в попытках найти философский камень. Бранд был поражен тем, что полученное вещество светилось в темноте.
Группа (15 / V A)
Расположен в 15‑й группе. В периодической системе фосфор находится в одной вертикальной колонке с азотом (выше) и мышьяком (ниже) и относиться к (подгруппе азота).
Химический потенциал:
- Валентность фосфора: переменная валентность III и V.
- Степень окисления: от -3 до +5. Наиболее стабильные соединения образуются в высшей степени окисления +5 (P2O5, ортофосфорная кислота).
Период (3‑й)
Находится в 3‑м периоде — его электроны распределены по трем энергетическим уровням.
Влияние на свойства:
- Химическая активность: Белый фосфор чрезвычайно активен и самовоспламеняется на воздухе, в то время как красный фосфор относительно стабилен.
- Техническое значение: Используется для создания «фосфористой бронзы» — сплава, который отличается высокой твердостью и сопротивлением истиранию, что описано в справочнике ГТТИ 1934 г.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(P) ≈ 30,9737 а.е.м.
- Определение: значение массы единственного стабильного природного изотопа — Фосфора-31.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Идет заполнение 3p‑подуровня (3p3).
Специфика блока: Как типичный представитель p-блока, фосфор проявляет выраженные неметаллические свойства, образуя летучие водородные соединения (фосфин PH3) и кислотные оксиды.
Определение энергетических уровней Фосфора по Таблице Менделеева
Положение Фосфора (P) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 3-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Фосфора 3 энергетических уровня.
2. Список «жильцов» (Распределение электронов)
Атомный номер Фосфора — 15. Его 15 электронов распределены по уровням следующим образом:
P ) 2 ) 8 ) 5
3. 15-я группа (Химический характер)
Фосфор — элемент главной подгруппы V группы (или 15-й группы).
- p-элемент: Типичный неметалл.
- Физические свойства: Имеет несколько модификаций; красный фосфор — порошок, белый фосфор — воскообразное ядовитое вещество.
Проверка знаний: Как определить фосфор по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Фосфор (P) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 15. Указывает на заряд ядра (количество протонов).
- 2) 3-й период, 15-й группа. Его адрес в периодической системе.
- 3) p-элемент. Электронное семейство, определяющее неметаллический характер.
- 4) Ошибка. Фосфор — неметалл. Щелочные металлы находятся в 1-й группе.
- 5) Ошибка. d-элементы — это переходные металлы.
- 6) Ошибка. Атомная масса фосфора около 31 а.е.м.
Часто задаваемые вопросы:
Фосфор расположен в 3-м периоде, 15-й группе. Его порядковый номер — 15.
У фосфора 3 энергетических уровня.
Электронная схема: 2, 8, 5.
Фосфор является p-элементом. В его атоме электронами заполняется внешний p-подуровень.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.