Теория:
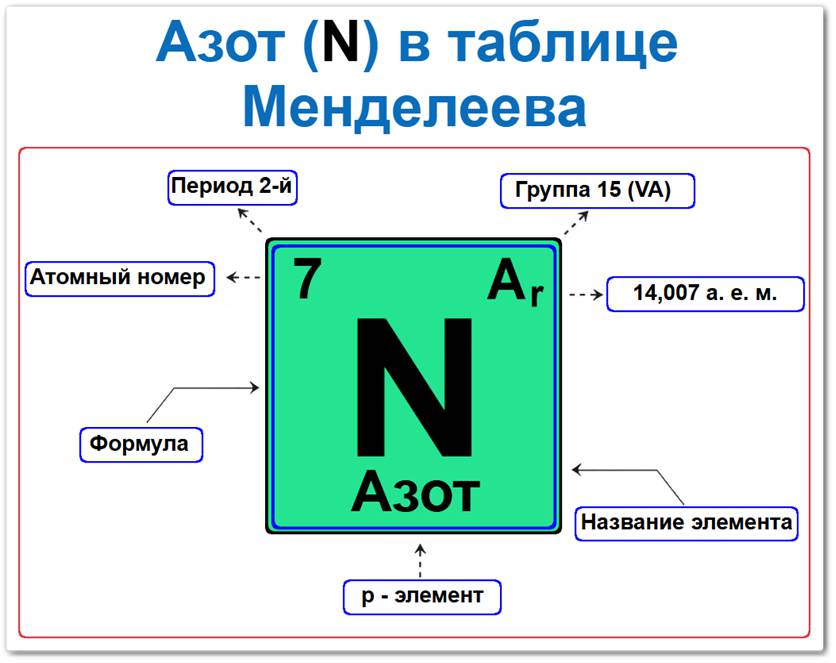
Азот (N) в периодической системе: 2‑й период, 15‑я группа (по устаревшей классификации — V A), атомная масса 14,007 а.е.м.
Занимает положение во 2‑м периоде, что определяет его принадлежность к p-элементам и группе неметаллов.
Азот — самый распространенный элемент в атмосфере Земли (составляет около 78% её объема).
В свободном виде представляет собой газ без цвета, вкуса и запаха (N2), который крайне инертен при нормальных условиях.
Будучи химическим элементом p-блока, он располагается в верхней правой части таблицы Менделеева, находясь над фосфором и между углеродом и кислородом, являясь типичным неметаллом.
Нахождение Азота в 15‑й группе и наличие пяти валентных электронов обуславливают его ключевые параметры:
Переменную валентность (от I до IV, чаще всего III) и способность образовывать прочную тройную связь в молекуле газа.
А также фундаментальное значение для жизни (входит в состав белков и ДНК), производство удобрений (аммиак), использование в криогенике (жидкий азот) и создание инертной среды при сварке или упаковке продуктов.
Структура атома подтверждается его электронной формулой (конфигурацией):
1s2 2s2 2p3 (или [He] 2s2 2p3).
На которой наглядно можно определить его положение как p-блочного элемента, находящегося в начале заполнения внешнего 2p-подуровня.
Азот элемент таблицы Менделеева который можно определить на основании закона периодичности: положение в ряду пниктогенов период 2, группа 15, а также по его порядковому номеру (Z = 7).
Как определить положение Азота в Таблице Менделеева
Локация азота в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (15-я группа, подгруппа азота).
- Период (горизонтальный ряд).
- Электронное семейство (азот — p‑элемент).
Порядковый номер / атомный номер (Z = 7)
- Служит уникальным кодом элемента в системе.
- В ядре — 7 протонов; в нейтральной оболочке — 7 электронов.
- Электронное строение: 2, 5.
Важно: Для мастера азот — это прежде всего защита металла. В справочниках по металлообработке часто упоминается «азотирование» — процесс насыщения поверхности стали азотом для придания ей сверхвысокой твердости и износостойкости. Инструмент после такой закалки служит в разы дольше.
Название и символ
- Название: «азот» (от др.-греч. a-zoos — «безжизненный», так как он не поддерживает дыхание).
- Символ: N (Nitrogenium).
- Примечание: Антуан Лавуазье предложил это название в 1787 году. В быту мы часто используем азотные удобрения (селитру) для взрывного роста растений в саду.
Группа (15 / V A)
Расположен в 15‑й группе. В периодической системе азот возглавляет вертикальную колонку, находясь над фосфором (снизу) и относится к (подгруппе азота / пниктогенам).
Химический потенциал:
- Валентность азота: типичная валентность III и IV (валентность V для азота невозможна из-за отсутствия d-подуровня).
- Степень окисления: от -3 (в аммиаке) до +5 (в азотной кислоте). Азотная кислота — один из самых мощных растворителей, способный «съесть» почти любой металл.
Период (2‑й)
Находится во 2‑м периоде — его электроны распределены всего по двум энергетическим уровням.
Влияние на свойства:
- Химическая активность: Из-за очень прочной связи между двумя атомами в молекуле N2, азот «ленив» и вступает в реакции только при сильном нагреве или под действием молний.
- Техническое значение: Жидкий азот ($–196$ °C) — незаменимая вещь для быстрой заморозки и ремонта, когда нужно «сжать» металлическую деталь, чтобы она вошла в паз.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Period).
Относительная атомная масса (Ar)
- Ar(N) ≈ 14,007 а.е.м.
- Определение: среднее значение массы природных изотопов, основным из которых является Азот-14 (99,6%).
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Заполняется внешний 2p‑подуровень (2p3).
Специфика блока: Азот является типичным неметаллом. На внешнем уровне у него 5 электронов, и ему не хватает всего 3-х для завершения слоя, что делает его сильным окислителем в определенных реакциях.
Определение энергетических уровней Азота по Таблице Менделеева
Положение Азота (N) в системе Менделеева дает четкую схему его строения.
1. 2-й период (Количество этажей)
- Итог: У Азота 2 энергетических уровня.
2. Список «жильцов» (Распределение электронов)
Атомный номер Азота — 7. Его 7 электронов распределены по уровням:
N ) 2 ) 5
3. 15-я группа (Химический характер)
- p-элемент: Относится к семейству пниктогенов.
- Металлические свойства: Отсутствуют; типичный электроотрицательный неметалл.
Проверка знаний: Как определить азот по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Азот (N) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 7. Соответствует количеству протонов.
- 2) 2-й период, 15-й группа. Его положение в системе.
- 3) p-элемент. Указывает на структуру внешней оболочки.
- 4) Ошибка. Щелочные металлы — это 1-я группа.
- 5) Ошибка. Азот — это газ.
- 6) Ошибка. 15 — это номер группы, а не элемента.
Часто задаваемые вопросы:
Азот расположен во 2-м периоде, 15-й группе. Порядковый номер — 7.
У азота 2 энергетических уровня. Схема: 2, 5.
В чистом азоте нельзя дышать (человек задохнется) и он не поддерживает горение костра.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.