N (азот) — химический элемент пятнадцатой группы (15) с порядковым номером 7 в периодической системе.
Находится во II периоде. Температура плавления: -209.9 ℃. Плотность: 0.00117 г/см3, атомной номер 7, атомная масса 14,0067.
Электронная формула
Электронная формула атома азота:
1s2 2s2 2p3
Сокращенная электронная конфигурация N:
[He] 2s2 2p3
Электронно-графическая схема азота (N)
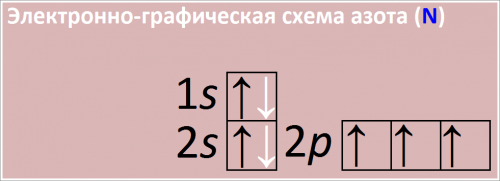
Рис. Схема распределения электронов по атомным орбиталям в атоме азота.
Энергетические уровни
Распределение электронов по энергетическим уровням в атоме азота N:
1-й уровень (K): 2
2-й уровень (L): 5

Рис. Распределение электронов по энергетическим уровням в атоме азота N.
Валентные электроны азота
Количество валентных электронов в атоме азота — 5.
Таблица квантовых чисел азота (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 2 | 0 | 0 | +1/2 |
| s | 2 | 0 | 0 | -1/2 |
| p | 2 | 1 | -1 | +1/2 |
| p | 2 | 1 | 0 | +1/2 |
| p | 2 | 1 | 1 | +1/2 |
Степень окисления азота равны: −3 −2 −1 +1 +2 +3 +4 +5.
Стабильные изотопы
Природная смесь состоит из двух стабильных изотопов : N — 99,6% и N — 0,37% .
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 14N | 7 | 7 | 14.0030740048 |
| 15N | 7 | 8 | 15.0001088982 |
Искусственно получены радиоактивные изотопы:
- 12N с периодом полураспада 0, 0125 с. излучающий позитроны.
- 13N с периодом полураспада 9,93 мин.
Также излучает позитроны:
- 14N с периодом полураспада 4,1 с β- излучением,
- 15N с периодом полураспада 7,3 с и тоже с β — излучением.
- Изотоп 13N , отличается наибольшей продолжительностью жизни.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.