Щёлочноземельные металлы — химические элементы 2-й группы (устаревшая классификация: главная подгруппа II группы) входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra.
Из них кальций, стронций, барий относят к семейству щелочноземельных металлов.
Распределение электронов по энергетическим уровням в атомах этих металлов приведено в таблице 1.
Металлы главной подгруппы II группы
Таблица электронов по энергетическим уровням
| Металл | Заряд ядра | Число электронов на энергетических уровнях | Радиус атома Å | ||||||
| K | L | M | N | O | P | Q | |||
| Бериллий Be | +4 | 2 | 2 | 1,05 | |||||
| Магний Mg | +12 | 2 | 8 | 2 | 1,60 | ||||
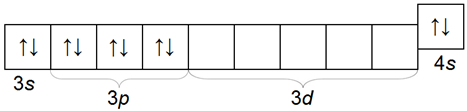
| Кальций Са | +20 | 2 | 8 | 8 | 2 | 1,97 | |||
| Стронций Sr | +38 | 2 | 8 | 18 | 8 | 2 | 2,13 | ||
| Барий Ва | +56 | 2 | 8 | 18 | 18 | 8 | 2 | 2,21 | |
| Радий Ra | +88 | 2 | 8 | 18 | 32 | 18 | 8 | 2 | 2,30 |
Если провести сравнение радиусов атомов элементов главной подгруппы II группы с I, то легко заметить, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах.
Это связано с некоторым сжатием электронных оболочек, так как s-оболочка внешнего электронного слоя у них завершена, поэтому электроны ими удерживаются сильнее.
Этим объясняется ряд химических свойств этих элементов.
Щелочноземельные металлы, как и щелочные, образуют окислы, взаимодействующие с водой, и растворимые в воде гидроокиси.
Наиболее легкий элемент группы — бериллий образует окись и гидроокись амфотерного характера. Валентных электронов у металлов главной подгруппы II группы два.
Располагаются они на внешнем электронном слое. Типичная степень окисления этих металлов +2.
Физические свойства металлов
Физические свойства бериллия, магния и щелочноземельных металлов приведены в табл. 21.
|
Металл |
Порядковый номер |
Атомный вес |
Температура плавления, °С |
Температура кипения, °С |
Плотность, г/смЗ |
|
Бериллий Be Магний Mg Кальций Са Стронций Sr Барий Ва Радий Ra |
4 12 20 38 56 88 |
9,01 24,31 40,08 87,62 137,34 226 |
1284 651 848 757 710 700 |
2474 1107 1492 1370 1618 1340 |
1,86 1,74 1,54 2,60 3,76 ~5,0 |
В окислительно-восстановительных реакциях щелочноземельные металлы ведут себя как сильные восстановители.
Из этой группы мы рассмотрим лишь магний и кальций как наиболее распространенные.
➡️ 40. Как объяснить, почему у атомов элементов главной подгруппы II группы происходит застройка s-оболочки внешнего слоя, а не d-оболочки предвнешнего слоя? (См. Ответ)
41. Выпишите в два столбца радиусы атомов щелочных металлов и металлов главной подгруппы второй группы. Сравните между собой соответствующие элементы, стоящие в одних и тех же периодах. Что можно сказать о сравнительной величине их атомных радиусов?
42. У каких металлов большая прочность металлической связи: в главной подгруппе I группы или в главной подгруппе II группы? Дайте обоснованный ответ.
43. Ответив на предыдущий вопрос, укажите, как можно, сравнивая между собой физические свойства металлов этих двух групп, обосновать сделанный вывод.
44. У каких металлов — щелочных или металлов главной подгруппы II группы ярче выражена электроположительность?
45. Почему гидроокиси металлов главной подгруппы II группы хуже растворяются в воде, чем гидроокись щелочных металлов.
46. Что можно сказать о поведении металлов II группы в окислительно-восстановительных реакциях? (См. Ответ)
Магний и его соединения
Электронная конфигурация атома магния 1s22s22p63s2. Структура его внешнего электронного слоя
Магний Mg — легкий серебристо-белый металл, довольно устойчивый к окислению, так как на воздухе покрывается защитной пленкой окиси.
Магний поступает в лаборатории в виде порошка или лент.
Магний является сильнейшим восстановителем. Если магниевую ленту поджечь, то она быстро сгорает с ослепительной вспышкой, развивая высокую температуру.
Поэтому магниевые вспышки применяются в фотографии, в изготовлении осветительных ракет, при поджигании термитных смесей и т. д.
При горении магния, как и прочих щелочноземельных металлов, образуется его окись:
2Mg + O2 = 2МgO
При горении магния развивается такая высокая температура, что он может гореть даже в двуокиси углерода, разлагая ее:
2Mg + СО2 = 2MgO + С
При горении на воздухе наряду с окисью магния образуется нитрид магния:
3Mg + N2 = Mg3N2
Магний является более активным металлом, чем водород, поэтому может реагировать с водой, вытесняя из нее водород:
Mg + 2Н2О = Mg(OH)2 + Н2 или Mg + Н2O = MgO + Н2
Реакция лучше происходит с горячей водой.
С кислотами магний реагирует весьма бурно, вытесняя водород.
• Составьте самостоятельно уравнение реакции.
Применение
Металлический магний широко используется при изготовлении легких сплавов. Примером может служить сплав «электрон», содержащий 80% Mg, 10% Al, 6% Zn, 0,2% Мn и прочие добавки.
Этот сплав применяется в авто- в авиастроении.
Среди кислородных соединений магния нужно отметить окись магния MgO, называемую также жженой магнезией, которая применяется в изготовлении огнеупорных кирпичей, так как ее температура плавления 2800º.
Используется жженая магнезия и в медицинской практике.
Соли
Гидроокись магния Mg(OH)2 является типичным основанием: весьма мало растворяется в воде.
Среди солей особый интерес представляет хлорид магния MgCl2, широко применяющийся при электролитическом получении магния.
В природе хлорид магния встречается в составе минерала карналлита KCl · MgCl · 6Н2O, откуда и извлекается.
Карбонат магния, или белая магнезия, встречается в природе в виде минерала магнезита MgCO3, а также входит в состав некоторых горных пород, например доломита MgCO3 СаСO3 в соединении с карбонатом кальция.
Из них и получают прокаливанием чистую жженую магнезию.
MgCO3 = MgO + CO2
В природных водах встречается бикарбонат магния Mg(CO3)2, придающий воде жесткость, о чем подробнее сказано ниже.
Интересны силикаты магния — тальк 3MgO · 4SiO2 · Н2O и асбест CaO · 3MgO · 4SiO2, обладающие высокой огнестойкостью.
Асбест имеет волокнистое строение, поэтому его можно прясть и изготавливать из него спецодежду для работы при высоких температурах. Карбонаты и силикаты магния в воде нерастворимы.
➡️ 47. Чем объяснить сравнительную устойчивость магния к окислению на воздухе? (См. Ответ)
48. Перечислите химические свойства магния, приведя уравнения реакций.
49. Напишите уравнения реакций (в молекулярной и ионных формах), с помощью которых можно получить сульфат магния всеми известными способами.
50. Составьте и заполните таблицу.
51. Опишите химические процессы, протекающие при получении магния электролизом расплава хлорида
52. Что такое «жженая магнезия» и «белая магнезия»?
53. Перечислите, где применяются соединения магния. (См. Ответ)
Кальций. Окись кальция. Гашеная известь
Кальций — элемент четвертого периода. Электронная конфигурация внешнего и предвнешнего электронных слоев атома кальция 3s23p64s2.
Кальций — один из наиболее распространенных элементов земной коры. Кроме силикатных пород, он встречается в виде карбоната СаСO3 (мел, мрамор, известняк) и сульфата CaSO4 (гипс).
Кальций представляет собой белый, легко окисляющийся на воздухе металл, поэтому его, подобно калию и натрию, хранят под слоем керосина. Кальций довольно тверд.
При окислении кальция на воздухе образуется окись кальция, или, как ее называют, жженая (негашеная ) известь СаО:
2Са + О2 = 2СаО
Предварительно нагретый кальций горит в кислороде, но не так ярко, как магний.
Кальций энергично реагирует с горячей водой, вытесняя из нее водород и образуя гидроокись кальция, или гашеную известь, Са(ОН)2:
Са + 2Н2О = Са(ОН)2 + Н2
С азотом кальций, подобно магнию, образует нитрид, но в двуокиси углерода гореть не может.
Кальций, подобно магнию, проявляет ярко выраженные восстановительные свойства. Широкого применения металлический кальций не находит.
Окись кальция СаО, как и жженая магнезия, имеет очень высокую температуру плавления — около 3000°.
Гашеная известь
Если облить СаО водой, то идет весьма бурная реакция, сопровождающаяся шипением, сильным разогреванием и увеличением объема.
В результате этого процесса, называемого гашением извести, получается гашеная известь — гидроокись кальция
СаО + Н2О = Са(ОН)2
Рис. 2. Схема известково-обжиговой печи
Гашеная известь широко используется в строительстве как связующее вещество и для изготовления штукатурки.
Гашеная известь, взболтанная в воде, называется известковым молоком и применяется в производстве сахара при его очистке от посторонних примесей.
Бесцветный прозрачный раствор гашеной извести называется известковой водой и применяется как реактив на двуокись углерода.
А также для смягчения временной жесткости воды, вызываемой бикарбонатом кальция Са(HCО3)2
Гашеную известь получают из негашеной, а негашеную — обжигом известняка в известково-обжиговых печах (рис. 2).
Смесь известняка и кокса, загружаемая через верх печи, называется шихтой. Кокс нужен для поддержания в печи температуры 1200°.
Для горения кокса необходим воздух, который подается снизу.
Постепенно проходя в печи через зону подогрева и зону охлаждения, известняк нагревается и разлагается:
СаСО3 = СаО + СО2
Негашеная известь охлаждается встречными потоками воздуха и извлекается из нижней части печи. Таким «образом, печь работает непрерывно.
Для того чтобы она могла выдержать столь высокий нагрев, ее футеруют изнутри огнеупорным кирпичом.
Летучие соединения кальция окрашивают пламя горелки в кирпично-красный цвет.
➡️ 54. Приведите несколько уравнений реакций, доказывающих, что кальций обладает восстановительными свойствами. (См. Ответ)
55. Какой объем водорода может быть вытеснен кальцием из 20 мл 3 н. соляной кислоты?
56. К какой группе реакций (экзотермическим или эндотермическим) относится процесс гашения извести?
57. Как осуществить следующие превращения: (См. Ответ)
58. Сколько кубических метров двуокиси углерода получится при прокаливании 5 кг известняка, содержащего 10% примесей?
59. Почему для получения двуокиси углерода в аппарате Киппа пользуются соляной кислотой, обрабатывая ее мрамор, и никогда не пользуются серной?
60. Какие химические процессы протекают в известково-обжиговой печи?
61. Почему жженую известь нельзя длительное время хранить на воздухе?
62. В банке находится твердое белое вещество. Есть предположение, что это либо жженая, либо гашеная известь. Как определить, что в банке? (См. Ответ)
Жесткость воды и способы ее устранения
Протекая по известковым горным породам, вода, соединяясь с двуокисью углерода, переводит карбонаты кальция и магния в соответствующие растворимые кислые соли:
СаСО3 + Н2О + СО2 = Са(НСО3)2
СаСО3 + Н2О + СО2 = Са2+ + 2HCO3—
MgCО3 + Н2О + СО2 = Mg(HCO3)2
MgCО3 + Н2О + СО2 = Mg2+ + 2НСО3—
Бикарбонаты значительно лучше растворимы в воде, чем карбонаты; они переходят в раствор, и вода становится жесткой.
В такой воде плохо мылится мыло, плохо развариваются овощи, а при использовании такой воды в паровых котлах образуется накипь, которая может привести к взрыву котла.
Жесткую воду перед употреблением необходимо смягчать.
Существует три вида жесткости воды:
- Карбонатная, или временная, вызываемая присутствием бикарбонатов магния и кальция.
- Постоянная, вызываемая присутствием в воде сульфатов и хлоридов магния и кальция.
- Смешанная, которая вызывается наличием тех и других солей.
При устранении жесткости стремятся так или иначе удалить бикарбонаты магния или кальция из раствора, переводя их в нерастворимое состояние.
Например, временную жесткость можно устранить кипячением раствора.
При этом бикарбонаты кальция и магния разлагаются:
Са(НСО3)2 = СаСО3 + Н2О + СО2
Mg(HCО3)2 = MgCО3 + Н2О + СО2
Образующиеся карбонаты кальция и магния выпадают в осадок, и вода теряет жесткость.
Карбонатную жесткость нетрудно устранить прибавлением известковой воды:
Са(НСО3)2 + Са(ОН)2 = 2СаСО3 + 2Н2О
Эти способы неприменимы к воде с постоянной жесткостью.
Для ее устранения кальций и магний осаждают содой:
CaSО4 + Na2CО3 = CaCО3 + Na2SO4
Такой способ вполне применим и для устранения карбонатной, а следовательно, и смешанной жесткости:
Са(НСО3)2 + Na2CО3 = 2NaHCО3 + CaCО3
• Приведенные уравнения реакций устранения жесткости следует самостоятельно написать в ионной форме.
Жесткость воды выражается в градусах жесткости. Градусы жесткости показывают количество миллиграмм-эквивалентов ионов магния и кальция в 1 л воды.
➡️ 63. Какие виды жесткости воды вам известны? (См. Ответ)
64. Как можно устранить временную жесткость воды? Дайте обоснованный ответ.
65. Как можно устранить постоянную жесткость воды? Дайте обоснованный ответ.
66. Как устранить смешанную жесткость воды? Дайте обоснованный ответ.
67. При кипячении воды с временной жесткостью образуется накипь. Каков состав накипи? Как можно снять накипь химическим путем?
68. Можно ли устранить постоянную жесткость воды с помощью карбоната калия? Дайте обоснованный ответ.
69. Как измеряется жесткость воды?
70. Как распознать карбонат и сульфат кальция?
71. Как распознать сульфит и карбонат кальция?
72. Можно ли устранить временную жесткость воды соляной кислотой? Дайте обоснованный ответ, приведя уравнение реакции в молекулярной и ионных формах. (См. Ответ)
Статья на тему Металлы главной подгруппы II








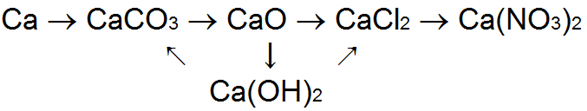
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.