Обоснование периодической системы элементов
Поскольку электроны в атоме располагаются на различных энергетических уровнях и образуют квантовые слои, логично предположить, что наружные электрону наиболее подвижны, так как сила притяжения их к ядру минимальна. Следовательно, химическое поведение атомов должно определяться главным образом строением наружных электронных уровней.
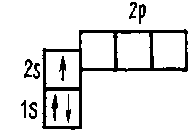
Рассмотрим строение электронных оболочек атомов расположенных в начале периодической системы Менделеева. В атоме водорода единственный электрон располагается на s-подуровне первого квантового слоя. Его состояние можно условно представить следующим образом: 1Н 1s1 или
На первом уровне может находиться не более двух электронов, поэтому следующий за водородом химический инертный элемент — гелий — имеет завершенную электронную оболочку: 2Не 1s2 или
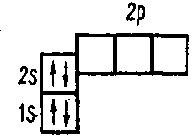
В соответствии с принципом Паули третий электрон в атоме лития поступает на s-подуровень второго электронного уровня 3Li 1s22s1 или
Застройка этого подуровня заканчивается в атомах бериллия 4Be 1s22s2
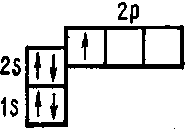
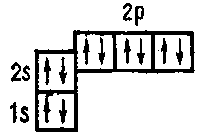
Пятый электрон атома бора занимает одну из ячеек 2р- подуровня 5B 1s22s2p1
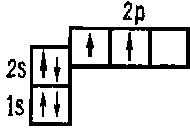
В пределах каждого подуровня электроны стремятся занят наибольшее число квантовых ячеек, чтобы их общий спин был максимальным (правило Хунда). В соответствии с этим правилом в электронной оболочке атома углерода заняты две ячейки 2р — подуровня: 6Cls22s2p2
Атом неона (Z=10) содержит максимально возможное число электронов. Благодаря высокой устойчивости запомненной электронной оболочки неон химически инертен 10Ne 1s 2s2 p6
В атомах элемента № 11 (натрий) начинает застраиваться новый энергетический уровень с n =3. Первые восемь элементов третьего периода имеют конфигурации:
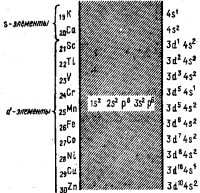
Казалось бы, что девятнадцатый электрон в атоме с Z = 19 должен находиться на 3d-подуровне. Но, поскольку полная энергия электрона определяется не только главным, но и орбитальным квантовым числом, заполнение подуровней происходит в соответствии с правилом Клечковского.
Для подуровня 3d сумма n +l = 3+2=5 больше, чем для подуровня 4s (n + l =4+0 = 4), поэтому девятнадцатый электрон в атоме калия занимает 45-подуровень. Таким образом, в атомах элементов четвертого периода сначала заполняется 4s-подуровень и только после этого— подуровень 3d. В атомах хрома и меди один 4s-электрон переходит на подуровень 3d. Это явление называется «провалом» электрона:
Как только 3d-подуровень полностью заполняется, начинает застраиваться подуровень 4р (n + l =4+1=5):
Аналогично можно проследить строение электронных оболочек атомов всех других элементов. Появляющееся в шестом периоде семейство лантаноидов объединяет элементы с заполняющимся 4f-подуровнем. Их химические свойства очень сходны.
Статья на тему Обоснование периодической системы элементов





Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.