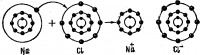
Ионная связь это химическая связь между атомами с большой разностью электроотрицательностей, образуется между металлом и не металлами, например реакция натрия с хлором, здесь атом натрия отдает свой электрон, а хлор принимает его становясь отрицательно заряженным.
Что такое ионная связь
Ионная связь образуется между атомами с низкими потенциалами ионизации и атомами, обладающими большим сродством к электрону, т. е. между элементами начала и конца каждого периода. Легче всего связь ионного типа возникает при взаимодействии щелочных металлов с галогенами или кислородом. Стремясь окружить себя устойчивой электронной оболочкой, атомы щелочных металлов легко теряют наружный s-электрон, превращаясь в однозарядные положительные ионы с электронной конфигурацией предшествующего инертного элемента.
Для того чтобы иметь электронную оболочку инертного газа, атомам щелочноземельных металлов необходимо отдать уже два своих наружных электрона. Этот процесс требует значительно большей затраты энергии, поэтому образование двухзарядных положительных ионов происходит с большим трудом, чем однозарядных. С потерей двух электронов атом магния становится катионом Mg2+, атом кальция — катионом Са2+ и т. д.
Mg (1s22s2p63s2)→ -2ē →Mg2+(1s22s2p6)
Точно так же атомы неметаллов VI и VII групп периодической системы, присоединяя недостающие электроны, приобретают конфигурации последующих инертных элементов: неона и аргона.
Ионная связь пример
При сближении атома щелочного металла с атомом галогена происходит следующее перераспределение электронов: внешний s-электрон атома металла переходит на р- подуровень атома галогена. Образовавшиеся ионы удерживаются друг около друга с помощью электростатических сил. Этот процесс сопровождается понижением энергии и образованием нового химического соединения. Например, при реакции хлора с натрием получаются бесцветные кристаллы поваренной соли NaCl.
В общем случае образование ионной связи можно представить в виде следующей схемы смотреть (рис. 1).
Атом А отдает свой электрон, становясь при этом катионом А+; атом В принимает электрон и превращается в отрицательно заряженный ион В—. Схема ионной связи выглядит более наглядно, если изобразить энергетические уровни взаимодействующих атомов, например:
Свойства ионной связи
Электрическое поле иона сферически симметрично, т. е. распределено в пространстве равномерно по всем направлениям. Поэтому сила притяжения F двух противоположно заряженных ионов друг к другу совершенно не зависит от их взаимного расположения:
F = q2/r2
где q—заряд каждого иона; r—расстояние между центрами зарядов. Под действием этой силы ионы сближаются до расстояния r0, на котором кулоновское притяжение уравновешивается отталкиванием электронных оболочек. Потенциальная энергия системы А++В— имеет при таком положении ионов минимальное значение, отражая тем самым факт образования устойчивой молекулы А+В—.
Длина ионной связи некоторых веществ
Длина ионной связи равна расстоянию r0 между электрическими центрами ионов; она меняется в зависимости от природы взаимодействующих атомов таблица длина ионной связи :
| Молекула | Длина связи | Молекула | Длина связи |
| LiF | 1,56 | LiBr | 2,17 |
| NaF | 1,93 | NaBr | 2,50 |
| KF | 2,17 | KBr | 2,82 |
| RbF | 2,27 | RbBr | 2,94 |
| CsF | 2,35 | CsBr | 3,07 |
| LiCl | 2,02 | LiI | 2,39 |
| NaCl | 2,36 | NaI | 2,71 |
| KCl | 2,67 | KI | 3,05 |
| RbCl | 2,79 | RbI | 3,18 |
| CsCl | 2,91 | CsI | 3,32 |
Поскольку кулоновские силы достаточно велики, ионные соединения при обычных условиях представляют собой твердые кристаллические вещества с высокими температурами плавления и кипения. Их водные растворы и расплавы, как правило, очень хорошо проводят электрический ток.
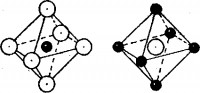
Рис. 3. Взаимная координация ионов Сl— и Na+ в кристалле хлорида натрия
При соединении двух противоположно заряженных ионов их электрические поля замыкаются друг на друга. Однако полной компенсации этих полей не происходит. Притянувшиеся друг к другу разноименные ионы сохраняют способность к электростатическому взаимодействию с другими заряженными частицами. Это свойство ионной связи называется не насыщаемостью.
Когда в 1913 г. с помощью рентгеновских лучей была определена структура кристаллов хлорида натрия, то оказалось, что в этих кристаллах нет отдельных молекул Na+Cl— Вследствие ненаправленности и не насыщаемости кулоновских сил каждый катион Na+ окружен шестью ионами хлора, а каждый анион Сl—— шестью ионами натрия (рис.3). Ионные молекулы Na+Cl— существуют только при очень высоких температурах в газообразном состоянии.
Статья на тему Ионная связь


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.