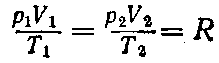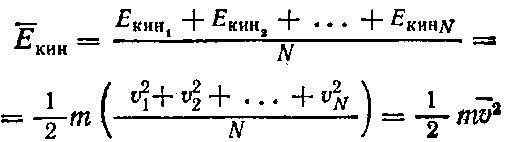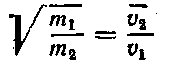Упрощенной моделью газообразного состояния вещества является идеальный газ.
Предполагается, что он состоит из совершенно одинаковых (однородных) шарообразных, абсолютно упругих молекул, находящихся в состоянии непрерывного и беспорядочного теплового движения.
Собственный объем молекул бесконечно мал по сравнению со всем объемом газа; поэтому их можно считать точками, обладающими определенной массой.
За исключением моментов столкновений молекулы идеального газа между собой не взаимодействуют.
Удары молекул друг о друга или о стенки сосуда, в котором находится идеальный газ, являются абсолютно упругими (происходит только обмен кинетической энергией между частицами, а полная энергия при каждом столкновении сохраняется).
В период между столкновениями молекулы движутся прямолинейно.
Идеальные газы это
Идеальный газ подчиняется определенным законам в любой области температур и давлений.
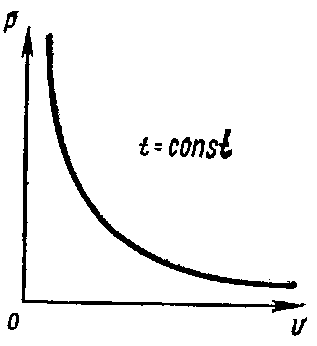
При неизменной температуре давление газа обратно пропорционально занимаемому им объему (закон Бойля-Мариотта):
pV = Kt
где Kt — постоянная, зависящая от температуры и массы in газа. Закон Бойля—Мариотта можно представить графически ветвью гиперболы в координатах р и V (рис.).
При постоянном объеме давление газа линейно изменяется с температурой (закон Шарля):
p = p0(1 + αt)
где t— температура в °С; р0— давление газа при 0°С; α — коэффициент пропорциональности, численно равный 1/273.
Рис. Графическое выражение закона Бойля— Мариотта в координатах р и V
С помощью несложного алгебраического преобразования это уравнение можно привести к виду:
p = p0(273 + t)/273
Заменив сумму (273+ t) величиной Т, получаем:
p = p0(T/273)
(Т — температура по Кельвину).
Теперь закон Шарля принимает следующий вид:
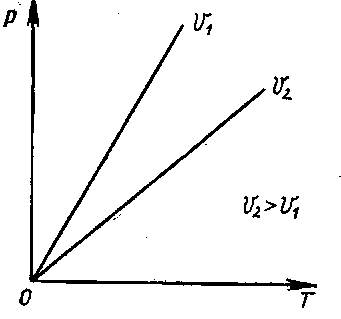
p/T = Kυ[Kυ = f(V,m)]
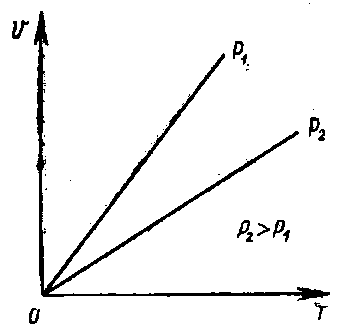
В координатах р и Т закон Шарля выражается графически в виде прямой линии (рис. 2).
Рис. 2. Графическое выражение закона Шарля в координатах р и Т.
При постоянном давлении объем газа линейно изменяется с температурой (закон Гей-Люссака)
V = V0(l+af),
где t и а имеют те же значения; V0 — объем газа при 0°С.
Переходя к температурной шкале Кельвина, получаем:
V/T= КР [Kp = f(p, т)]
Закон Гей-Люссака выражается графически в координатах V и Т в виде прямой линии (рис. 3).
Переменные величины р и Т, описывающие состояние идеального газа, называются его основными параметрами состояния.
Они связаны между собой простым соотношением:
pV/T = K
где К — постоянная, зависящая только от массы m газа.
Если принять тn = 1 моль, то величина К перестает быть зависящей от каких-либо параметров.
В этом случае ее обозначают латинской буквой R и называют универсальной газовой постоянной.
Следовательно, для одного моля газообразного вещества можно написать:
В системе СИ
= 8,314 дж/моль • град
Для п молей уравнение состояния идеального газа принимает вид:
pV/T = nR
Или, учитывая, что n = m/M (т — масса газа, М — его молекулярная масса),
Таким образом, измерив давление р, объем V и температуру Т массы m газа, легко можно вычислить его молекулярную массу из соотношения:
М = m(RT/pV)
Температура идеального газа прямо пропорциональна средней кинетической энергии поступательного движения его молекул:
T ~ Ēкин
Поскольку скорости движения каждой из N молекул различны то:
Для двух идеальных газов, находящихся при одной и той же абсолютной температуре, m1υ12=m2υ22 или, что то же самое:
Следовательно, средняя квадратичная скорость движения молекул обратно пропорциональна корню квадратному из их массы.
Молекула водорода и идеальный газ
При атмосферном давлении и температуре 300 К средние квадратичные скорости молекул водорода, кислорода и азота равны соответственно 1838, 461 и 493 м/сек.
Благодаря незначительной молекулярной массе водород обладает гораздо более высокими скоростями диффузии по сравнению с другими газами.
По этой причине он хорошо проводит теплоту и применяется для охлаждения подшипников мощных электрических машин.
При повышенной температуре газообразный водород довольно быстро диффундирует сквозь металлы, что приходится учитывать при конструировании химической aппаратуры.
В процессе диффузии могут получаться различные гидриды постоянного и переменного составов.
Например, в паровых котлах образуется гидрид железа, присутствие которого в толще металла снижает прочность стенок и может привести к взрыву.
Статья на тему Идеальный газ