Электролиз воды и водных растворов
Электролиз воды это процесс разложение воды электрическим током используют различные электролизеры, например аппарат Гофмана и др.
Раньше они входили в состав оборудования школьных кабинетов химии.
Но эти приборы с платиновыми и серебряными электродами дорогие, хрупкие и недолговечные.
Электроды из благородных металлов заменили свинцовыми и никелевыми.
Приборы стали прочнее, но имели существенный недостаток— образование вторичных продуктов электролиза.
Было предложено много самодельных приборов для электролиза воды. Материалом для электродов служило железо, а электролитом был раствор щелочи.
В таких самодельных приборах можно получить водород и кислород в объемных отношениях приблизительно как 2 : 1.
Термическое разложение воды
В то время как электролиз воды проходит при обыкновенной температуре, термическое разложение воды требует нагревания до очень высокой температуры (выше 1000 °С), что свидетельствует о прочности этого соединения.
Так, пары воды частично разлагаются на водород и кислород при сильном нагревании платиновой спирали, которую можно заменить спиралью из других тугоплавких металлов (например, вольфрама).
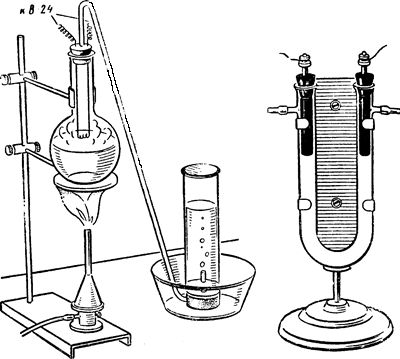
Установка для термического разложения (диссоциации) воды изображена на рисунке 2.
Меры предосторожности. Перед раскаливанием спирали необходимо удалить из установки воздух, для чего воду в колбе кипятят.
Провода подключают к источнику электрического тока (через ВС-24М или В-24).
Цилиндр с собранной гремучей смесью обертывают полотенцем и подносят к пламени.
Электролиз водных растворов солей
Прибор для электролиза растворов солей (рис. Б) представляет собой дугообразную трубку с двумя отростками для отвода образующихся газов, например хлора и водорода при электролизе раствора хлорида натрия.
Электроды — угольные (графитовые) стержни.
Рис. 2 — А. Установка для термического разложения воды.
Рис. 2 — Б. Прибор для электролиза растворов солей.
Опыты по электролизу воды и водных растворов солей можно осуществить в приборе для опытов по химии с электрическим током.
Демонстрация электролиза воды
Для демонстрации электролиза воды в электролизер наливают дистиллированную воду так, чтобы уровень ее на 2— 3 см был выше электродов.
В качестве электролита используют 10%-ный раствор гидроксида натрия. В две демонстрационные пробирки (ПХ-21) также наливают дистиллированную воду с добавлением электролита.
Пробирки поочередно закрывают пробкой с держателем, опрокидывают вверх дном в электролизер; открывают под водой пробку и надевают пробирки на электроды.
Прибор подключают к источнику постоянного тока с напряжением 40 В (ИЭПП-1 или ИЭПП—2) при условии, что контакт экспериментатора с электролитом исключен.
Для этого в старых образцах набора следует сделать к электролизеру крышку (из картона, дерева, пластмассы) с отверстиями для пробирок.
В противном случае нельзя пользоваться электрическим током с напряжением свыше 12 В.
Аналогично проводят опыт по электролизу водного раствора иодида калия.
Электролизер и демонстрационные пробирки заполняют раствором иодида калия.
В одну из пробирок, которую надевают на катод, добавляют 1 — 2 капли фенолфталеина, а во вторую — 2 — 3 капли крахмального клейстера.
Подключают прибор к источнику постоянного тока и через 1 — 2 мин (U 40В) наблюдают малиновое окрашивание в катодном пространстве (в пробирке с фенолфталеином) и синее — в анодном (в пробирке с крахмалом).
Практическое значение имеет электролиз раствора хлорида натрия, дающий три важных продукта:
- Гидроксид натрия.
- Хлор.
- Водород.
Из последних двух продуктов может быть получена синтетическая соляная кислота.
Электролиз хлорида натрия
Лабораторные установки для электролиза раствора хлорида натрия рассматриваются в руководствах по химическому эксперименту.
Одна из таких установок была предложена М. В. Федякиным (журнал «Химия в школе», 1964, № 5).
Она состоит из стеклянной трубки ( 30 мм), закрытой двумя резиновыми пробками.
В прибор через воронку наливают насыщенный раствор хлорида натрия до уровня, показанного на рисунке.
Установку подключают к источнику постоянного тока напряжением 15 — 20 В,
При электролизе на катоде 4 выделяется водород, который собирают над трубкой 6 в пробирку и испытывают на горючесть.
Выделяющийся на аноде хлор выводится по газоотводной трубке в сосуд с иодокрахмальным раствором (на рисунке не показано).
Сливают в отдельные стаканы жидкость из анодного пространства и катодного пространства, а в третий стакан — исходный раствор хлорида натрия.
Во все три стакана прибавляют раствор лакмуса (фиолетового цвета).
Исходный раствор показывает нейтральную реакцию, жидкость при катоде — щелочную, а при аноде — разрушает лакмус (действие растворенного хлора).
Установка для электролиза солей
Установку для электролизера растворов солей (а также воды) можно собрать из специальных деталей набора НДПХ. В качестве электролизера используют Н-образную трубку-реактор 1 ( с кранами 2 и 4), в которую вставляют две пробки с электродами: железным и угольным.
В колбу при закрытом зажиме наливают прозрачный насыщенный раствор хлорида натрия, заготовленный заранее. К клеммам электродов присоединяют проводники от источника постоянного тока ВС-24М (В-24). Напряжение тока 25—30 В, сила тока 4 А. Через 2—3 мин колбу поднимают на демонстрационный столик.
Водород собирают в пробирку, открывают кран и доказывают наличие газа. В пробирку над краном помещают иодокрахмальную бумажку , с помощью которой доказывают наличие хлора.
Получившийся раствор щелочи берут из электролизера в пробирку через тройник с зажимом. Проводят испытание раствора щелочи фенолфталеином.
Вывод
Электролиз воды и водных растворов представляет собой важный экспериментальный метод, который наглядно демонстрирует химические реакции и процессы разделения веществ.
Благодаря простоте и доступности самодельных установок, данный процесс стал популярен не только в образовательных учреждениях, но и среди любителей науки.
Современные технологии позволяют отказаться от использования дорогих и хрупких электродов, предлагая более устойчивые материалы, которые обеспечивают эффективность и безопасность проведения опытов.
Применение электролиза в лабораторной практике расширяет горизонты химических исследований и обеспечивает получение значимых продуктов, таких как водород, кислород и хлор.
Эти вещества играют важную роль в химической промышленности и могут быть использованы для синтеза других соединений, включая соляную кислоту.
Опыт по электролизу также способствует изучению и пониманию основ электрохимии, открывая возможности для дальнейших исследований и экспериментов.
Таким образом, электролиз не только служит основой для учебных экспериментов, но и является важным инструментом в химической науке, способствуя ее развитию и популяризации.
Статья на тему Электролиз воды


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.