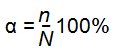Диссоциация оснований кислот и солей это процесс растворения или распада.
В физике, химии и биохимии обозначает разрушение сложных химических соединений на их основные компоненты или элементы.
Рассматривают два типа:
- Электролитическая.
- Термическая.
Электролитическая представляет собой особый вид, при котором молекулы электролита распадаются на ионы под влиянием молекул растворителя.
Термическая это еще одна форма, которая происходит в результате нагрева или охлаждения вещества.
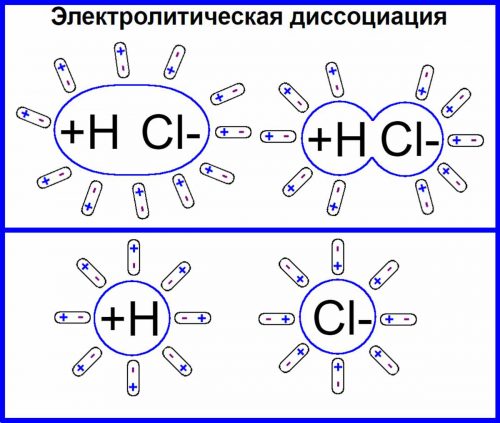
Электролитическая диссоциация кислот оснований и солей
На ионы могут распадаться только соединения, молекулы которых построены по ионному или полярному типу связи, рассматривая это на примере NaCl и НСl.
Что касается неполярных молекул, то они в водных растворах на ионы не распадаются.
Однако нередко встречаются вещества, в молекулах которых наблюдаются оба типа связи, например в молекуле едкого натра NaOH металл натрий связан с гидроксилом ионной связью.
А водород с кислородом — ковалентной.
В молекуле серной кислоты H2SО4 водород с кислотным остатком связан полярной связью, а сера с кислородом — ковалентной неполярной.
В молекуле нитрата алюминия Al(NO3)3 алюминий связан с кислотным остатком ионной связью, а атомы азота с атомами кислорода—ковалентной.
В таких случаях распад молекулы на ионы происходит по месту ионной или полярной связи.
Ковалентные связи остаются недиссоциированными.
Из сказанного следует, что ионами могут являться не только отдельные атомы, но и группы атомов.
Например, гидроксил при диссоциации образует один анион ОН-, который так и называется гидроксил-ион.
Кислотный остаток SO4 образует двухзарядный анион — сульфат-ион. Заряд каждого иона определяется его валентностью.
Теперь можно рассмотреть, на какие ионы диссоциируют разные классы неорганических веществ.
Пример уравнения диссоциации
Подобно уравнениям химических реакций, уравнения диссоциации также можно записывать.
Например, распад на ионы едкого натра записывают так:
NaOH = Na++ ОН—
Иногда вместо знака равенства в таких уравнениях ставят знак обратимости ⇄ чтобы показать, что диссоциация — процесс обратимый и при удалении растворителя может протекать в обратную сторону.
Гидроокись кальция диссоциирует так:
Са(ОН)2= Са2++ 2OН—
(индекс, указывающий число гидроксильных групп, становится коэффициентом).
Для проверки правильности записи следует подсчитать суммарный положительный заряд катионов и суммарный отрицательный заряд анионов.
Они должны быть равны по абсолютной величине. В данном случае сумма положительных зарядов +2, а отрицательных -2.
Из сказанного возникает определение оснований в свете теории электролитической диссоциации.
Основаниями являются такие электролиты, которые диссоциируют в растворе с образованием только катиона металла и анионов гидроксила.
➡️ 75. Напишите уравнения диссоциации следующих оснований, проверив предварительно по таблице растворимости, являются ли они электролитами: гидроокись бария, гидроокись железа, гидроокись калия, гидроокись стронция, гидроокись цинка, гидроокись лития.
Распад на ионы кислот
Распад на ионы кислот происходит там, где имеет место полярная связь, т. е. между атомом водорода и кислотным остатком. (См. Ответ)
Например, процесс диссоциации азотной кислоты выражается уравнением:
HNO3 = Н+ + NO3—
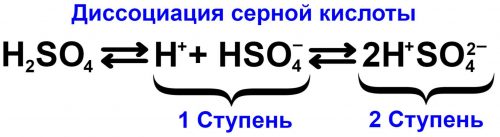
У двух- и более основных кислот она протекает ступенчато, например у Н2СO3:
Н2СO3 ⇄ Н+ + НСОз— (первая ступень) НСО3 ⇄ Н+ + CO23— (вторая ступень)
Ступенчатую диссоциацию иногда изображают в виде непрерывного равенства.
Н2СO3 ⇄ Н+ + НСО3— ⇄ 2Н+ + СO23—
При ступенчатой распад по ступеням сильно уменьшается, а на последней ступени он обычно очень небольшой.
Таким образом, кислотами являются электролиты, диссоциирующие в растворах с образованием в качестве катионов только ионов водорода.
➡️ 76. Напишите уравнения диссоциации следующих кислот: серной, фосфорной, сероводородной, сернистой, соляной. В случае двух- и более основных кислот уравнения пишите по ступеням. (См. Ответ).
Какое влияние оказывает внешняя оболочка ионов на характер диссоциации гидроксидов
Характер диссоциации оснований и кислот зависит от радиуса и заряда иона, образующего основание или кислоту.
Радиус иона Na+ больше радиуса иона Н+, поэтому электронные оболочки кислорода сильнее притягивают ядро водорода, чем ядро натрия.
Следовательно, при диссоциации быстрее должна разрываться связь Na-OН.
Чем больше радиус иона, образующего гидроокись, при одном и том же заряде, тем легче происходит диссоциация.
В одной и той же подгруппе гидроокись металла большим зарядом атомного ядра и, следовательно, с большим ионным радиусом будет диссоциировать сильнее.
➡️ 77. Пользуясь периодической системой элементов Д. И. Менделеева, укажите, какое из оснований будет диссоциировать сильнее: Mg(OH)2 или Sr(ОH)2. Почему? (См. Ответ).
Образование гидроокисей (или кислот)
В случае близких величин радиусов ионов, образующих гидроокись (или кислоту), характер диссоциации зависит от величины его заряда.
Так, поскольку заряд иона кремния в кремниевой кислоте H2SiО3 — Si(+4), а иона хлора в хлорной кислоте НСlO4 — Сl(+7), то последняя сильнее.
Чем больше положительный заряд иона, тем сильнее он отталкивает положительный ион водорода.
Происходит диссоциация по типу кислот.
Амфотерность гидроокиси бериллия (II период) объясняется своеобразным равновесием между силами отталкивания водородного иона и его притяжением ионом бериллия.
➡️ 78. Почему в III периоде периодической системы Д. И. Менделеева гидроокись магния проявляет основные свойства, гидроокись алюминия — амфотерные, а сера образует кислоту?
Объясните это, сравнив заряды и радиусы ионов магния, алюминия, серы. (См. Ответ).
Зависимость диссоциации от ионной связи
Поскольку в молекулах солей между атомами металла и кислотным остатком имеет место ионная связь, соли диссоциируют соответственно с образованием катионов металла и анионов кислотного остатка.
Например:
Al2(SO4)3 = 2Аl3+ + 3SO24—
Исходя из этого, солями называют электролиты, образующие при диссоциации в качестве катионов ионы металла, а в качестве анионов — ионы кислотного остатка.
➡️ 79. Напишите уравнения диссоциации следующих средних солей: фосфата натрия, нитрата магния, хлорида алюминия, силиката калия, карбоната натрия, сульфида калия, нитрата меди (II), хлорида железа (III). (См. Ответ)
Диссоциация кислых, основных и других солей протекает несколько иначе, о чем будет сказано ниже.
Степень диссоциации
Электролитическая диссоциация — процесс обратимый. Следовательно, одновременно с образованием ионов идет противоположный процесс — соединение ионов в молекулы.
Между ними устанавливается равновесие. Чем разбавленнее раствор, тем полнее происходит диссоциация.
О полноте диссоциации судят по величине степени диссоциации, обозначаемой буквой α.
Степень диссоциации это отношение числа диссоциированных молекул n к общему числу молекул N растворенного вещества, выраженное в процентах:
Другими словами, она показывает, какой процент растворенных молекул распался на ионы.
В зависимости от степени диссоциации различают электролиты сильные и слабые. Чем больше она, тем сильнее электролит.
По величине распада на ионы различают электролиты:
- Сильные.
- Средние.
- Слабые.
Сильные электролиты, например HNО3, НСl, H2SO4, едкие щелочи и все соли диссоциируют почти нацело (на 100%).
Вместе с тем к сильным электролитам относят и те, у которых α > 30%, т. е. более 30% молекул распалось на ионы.
Средние электролиты, например Н3РO4 и H2SO3, имеют степень диссоциации в пределах от 2 до 30%.
Слабые электролиты, например NH4OH, H2CO3, H2S диссоциируют плохо: α< 2%.
Сравнение степени диссоциации разных электролитов, производят в растворах одинаковой концентрации (чаще всего 0,1 н.), так как она сильно зависит от концентрации раствора.
На величину степени диссоциации влияет природа самого растворенного вещества, растворителя и ряд других внешних воздействий.
Таким образом, когда говорят «сильная кислота» или «сильное основание», имеют в виду степень диссоциации вещества в растворе.
В этом случае речь идет об этих веществах как электролитах.
От степени диссоциации того или иного вещества зависит его поведение в химической реакции и ход самой реакции.
➡️ 80. Что характеризует степень диссоциации α? (См. Ответ)