Меднение
В лабораторных условиях меднение железа производят путем окислительно восстановительной реакции, где восстановитель железо окислитель соль меди (в производстве используют данную реакцию для осаждения меди из его солей медный купорос, для этого через искусственные водоемы с железом пропускают его соль, медь осаждается на железе).
CuSО4 + Fe → FeSО4 + Cu
Медные покрытия, как правило, не применяются в качестве самостоятельного гальванического покрытия ни для декоративных целей, ни для защиты стальных изделий от коррозии. Это объясняется тем, что медь в атмосферных условиях окисляется, покрываясь с поверхности основными карбонатами (результат взаимодействия с влагой и углекислым газом воздуха).
По своим электрохимическим свойствам медь по отношению к железу является катодным покрытием, т. е. лишь механически предохраняет стальные изделия от коррозии. На поврежденном участке покрытия образуется гальваническая пара железо—медь, где железо будет являться анодом, а медь — катодом. Следовательно, медь будет ускорять коррозию железа. Медные покрытия используют в качестве подслоя при никелировании, хромировании и некоторых других процессах.
Медь легко полируется и дает прочное сцепление с другими металлами. В качестве самостоятельного покрытия медь применяется при углеродистой цементации железа, где медным покрытием защищаются отдельные участки изделий, не подлежащие цементации, а также в гальванопластическом производстве. Меднение осуществляется из сернокислых, цианистых, этилендиаминовых, пирофосфатных и других электролитов. Наибольшее распространение имеют сернокислый и цианистый электролиты.
Сернокислые медные электролиты
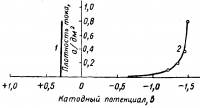
Осаждение меди на катоде происходит в основном за счет разряда ионов Сu2+, но возможно восстановление их до Сu+, а также разряд имеющихся в растворе ионов Сu+ на катоде. Схематически эти процессы можно изобразить следующим образом:
Сu2+ +2e → Сu Сu2+ +e → Сu+
Сu+ + е → Сu
При контакте с медными электродами в растворе устанавливается равновесие между ионами Cu2+, Сu+ и металлической медью.
Рис. 2. Катодная поляризация в медных сернокислых и цианистых электролитах;
1-1,5 н. раствор CuSО4+1,5 н. раствор H2SО4
Сульфаты Сu (II) ив особенности Cu(I) легко подвергаются гидролизу; образующиеся при этом гидроокись меди и закись меди будут включаться в катодный осадок и ухудшать его качество. Поэтому процесс осуществляют в подкисленном серной кислотой растворе. Кроме того, серная кислота повышает электропроводность электролита и снижает активность меди в нем, способствуя образованию мелкокристаллических осадков; однако с увеличением кислотности заметно падает растворимость сульфата меди, что также следует иметь в виду.
Катодная поляризация в кислых электролитах мала (рис. 2). Увеличение поляризации вызывают добавки декстрина, желатина, дисульфонафталиновой кислоты и некоторые другие. Эти добавки улучшают структуру медных осадков и увеличивают рассеивающую способность электролита.
В сернокислом электролите осаждение меди протекает при высоких выходах по току; электролит отличается устойчивостью и допускает работу при высоких плотностях тока. Недостатком сернокислого электролита является его невысокая рассеиваю способность и невозможность покрывать из этого электролита непосредственно железо и его сплавы. В момент погружения изделий в раствор железо вытесняет медь:
CuSО4 + Fe → FeSО4 + Cu
Выделяющаяся контактная медь непрочно связана с основой, поэтому при последующем наращивании образуется покрытие, легко отслаивающееся от основы. Понижение скорости контактного обмена может быть достигнуто предварительной пассивацией стальных изделий в концентрированной азотной кислоте или введением в электролит различных добавок (сульфат аммония, трибензиламин + тиомочевина), но эти эксперименты не вышли еще из стадии лабораторной проверки. В практике на стальные изделия предварительно осаждается тонкий подслой никеля или меди из цианистого электролита, затем наносится слой меди требуемой толщины из кислого электролита.
Кислые медные электролиты близки по составу к электролитам, применяемым в гидроэлектрометаллургии меди, но имеют меньшую кислотность.
Обычно применяемые медные кислые электролиты имеют состав (в г/л):
CuSО4 •5Н2О — 200—250
H2SО4 — — — 25—50
Температура электролита 20—50° С. Катодная плотность тока 2—5 а/дм2. Выход по току 95—98%. Перемешивание электролита (воздушное или механическое) позволяет увеличить плотность тока до 10—12 а/дм2.
Осадки меди из сернокислых электролитов без добавок, как уже отмечалось, имеют грубокристаллическую структуру, хорошо видимую под микроскопом уже при малых увеличениях. При введении в электролит добавок (дисульфонафталиновая кислота и др.) структура становится более тонкой.
К чистоте медных анодов не предъявляют особо высоких требований. Рекомендуется применение катаных анодов, так как литые аноды содержат заметные количества закиси меди и образуют много шлама. Не рекомендуется также электролитная медь; при растворении нарушается связь между отдельными кристаллами и происходит их выкрашивание.
Медные цианистые электролиты
Покрытия, получаемые из цианистого электролита, имеют мелкокристаллическую структуру (величина зерна в них колеблется в пределах 10-5÷10-7 см), дают хорошее сцепление с основой и покрывают металл весьма равномерно. Основным компонентом медных цианистых электролитов является комплексная
цианистая соль Na2[Cu(CN)3] или K2[Cu(CN)3]. Эта соль диссоциирует на ионы в две ступени
К2 [Си (CN)3] → 2К+ + [Сu(CN)3]2-[Сu(CN)3]2- → Сu+ + 3CN—
Благодаря образованию прочных комплексных ионов и малой степени диссоциации, концентрация ионов Сu+ничтожна и равновесный потенциал сдвинут в область отрицательных значений примерно на 1 в по сравнению со значением потенциала меди в сернокислых растворах. Поэтому медь из цианистых растворов не вытесняется железом.
Как видно из рис. 2, с увеличением плотности тока катодный потенциал меди в цианистых растворах резко смещается в сторону электроотрицательных значений. Катодная поляризация в сильной степени зависит от концентрации свободного цианида, возрастание ее увеличивает поляризацию. Наоборот, с повышением температуры поляризация уменьшается. Концентрация медной соли также влияет на катодную поляризацию. С увеличением концентрации медной соли потенциал сдвигается в область более положительных значений. Значительная поляризуемость и падение выхода по току при увеличении плотности тока обеспечивают высокую рассеивающую способность цианистого электролита.
Для приготовления электролита цианид меди растворяют в цианиде натрия или калия. В случае отсутствия цианида меди исходным материалом служит медный купорос. При действии KCN на CuSO4 первоначально образуется неустойчивый Cu(CN)2:
CuSO4 +2KCN → Сu(CN)2 + K2SO4
Сu(CN)2, распадаясь, выделяет CuCN и ядовитый дициан: 2Cu(CN)2 → 2CuCN + (CN)2
Можно исходить из свежеосажденного основного карбоната меди СuСО3 • Сu(ОН)2. В этом случае реакция протекает следующим образом:
СuСО3 • Сu(ОН)2 + 8KCN → 2К2[Сu(CN)3] + К2СO3+2КОН + (CN)2
Чтобы избежать потерь цианидов, при приготовлении растворов применяют восстановитель, обычно сульфит натрия, который предварительно переводит ионы Сu2+ в ионы Сu+. Суммарная реакция выражается при этом следующим уравнением:
2CuSO4 +2KCN Na2CO3 + Na2SO3 → 2CuCN + K2SO4 +2Na2SO4 + CO2
Для обеспечения нормальных условий работы медного цианистого электролита необходимо некоторое избыточное количество цианида. Если избытка KCN не будет, то на анодах образуете пленка трудно растворимой CuCN, вызывающая пассивацию анода. С другой стороны, большой избыток свободного цианид приводит к падению катодного выхода по току. Поэтому для каждого состава электролита и режима работы устанавливается своя определенная концентрация свободного цианида.
Кроме рассмотренных компонентов, в электролите присутствует в большем или меньшем количестве карбонат натрия, который накапливается при взаимодействии цианида натрия с углекислым газом воздуха. Присутствие карбоната натрия до известного предела считается полезным, так как он увеличивает электропроводность электролита.
Введение в электролит 0,5—1 г/л тиосульфата натрия способствует получению блестящих покрытий. В медные цианистые электролиты целесообразно вводить сегнетову соль, облегчающую растворение анодов за счет образования виннокислых комплексных соединений. Это позволяет вести электролиз при повышенных плотностях тока.
Наиболее простой медный цианистый электролит, применяемый при 18—25°С, имеет состав (в г/л):
CuCN — — — 40—50
KCN (свободный) — — — 12—18
Na2CО3 — — — 30
Катодная плотность тока 0,5—0,75 а/дм2. Выход по току 60—70%. При введении 50—60 г/л сегнетовой соли и температуре 50° С катодную плотность тока можно увеличить до 5 а/дм2.
Цианистые электролиты отличаются значительной неустойчивостью. На аноде наряду с растворением меди и выделением кислорода происходит образование дициана:
2CN— —2е → (CN)2
Последний взаимодействует с водой, образуя HCN и HCNO
(CN)2+2H2О → HCN + HCNO
Кислота HCNO подвергаются гидролизу:
HCNO + 2Н2О ⇄ МН3 + Н2СО3
что приводит к карбонизации электролита и уменьшению содержания цианидов в растворе.
Синильная кислота и ее соли могут подвергаться гидролизу с образованием муравьиной кислоты
HCN + 2H2О ⇄ HCOOH + NH3
Для получения гладких покрытий с высоким блеском применяют ток переменной полярности. Осаждение металла током переменной полярности может происходить лишь в том случае, если количество электричества, протекающее за время, когда покрываемое изделие поляризовано катодно, будет больше количества электричества, протекающего за время анодной поляризации. Часто применяемый режим характеризуется отношением tк • tа= 10:1, при длительности периода Т= 10 сек.
Чередуя в этих условиях катодное осаждение металла с его неполным анодным растворением, можно получить гладкое и даже блестящее покрытие при плотности тока более высокой, чем допустимая при ведении процесса на постоянном токе. Введения добавок (тиосульфат натрия, сегнетова соль и т. п.) при этом не требуется.
Электролиты для меднения
Кроме сернокислых и цианистых электролитов, в промышленности иногда используются пирофосфатные и этилендиаминовые электролиты.
Пирофосфорнокислый электролит приготовляют растворением сульфата меди в избытке пирофосфата натрия, при этом получается соль Na6[Cu(Р2О7)2], которая диссоциирует с образованием соответствующих ионов (Кн= 1,3 • 10-11). Электролит предназцачается для замены цианистого. Перед меднением в этом электролите стальное изделие рекомендуется для улучшения сцепления, анодно декапировать в 10% растворе Na4P2О7 в течение 0,5— 1,0 мин при анодной плотности тока 5—6 а/дм2. Б. А. Пурин предлагает для улучшения сцепления покрытия со стальной основой вводить добавки триоксиглутаровой кислоты и селенита натрия. Тем не менее по прочности сцепления покрытия из этого электролита уступают покрытиям, полученным в цианистом.
Медные покрытия могут быть получены из электролитов на основе этилендиаминовых комплексов. Осадки из этих электролитов получаются блестящими даже при больших толщинах, однако прочность сцепления медных покрытий со стальной основой из этилендиаминового электролита несколько хуже, чем при осаждении из цианистого электролита.
Статья на тему Меднение


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.