Основные методы получения кобальта в производстве
Заключительным этапом получения кобальта считается его анодное растворение, а затем электролитическое восстановление, также получение кобальта бывает электролитическое рафинирование огневого кобальта,но его меньше применяют из за специфики производства.
В лабораторных условиях кобальт получают восстановлением оксидов смеси СоО + Со3О4 + Со2О8 водородом.
Кобальт широко используют для производства сверхтвердых быстрорежущих и магнитных сплавов. Он является одним из важнейших стратегических металлов. Мировое получение кобальта составляет порядка 20000 т в год.
В природе кобальт встречается преимущественно в полиметаллических рудах (медно-кобальтовых, мышьяково кобальтовых, никелевых, медно-никелевых).
В зависимости от сырья и содержания в нем кобальта и других компонентов получение металла можно осуществлять различными металлургическими способами. Цель любого способа — получить промежуточный кобальтсодержащий продукт. Для извлечения кобальта из этого продукта, его вначале подвергают растворению в сульфатных или хлоридных растворах или в воде (если кобальт содержится в виде сульфата или хлорида). Реже применяется электролитическое (анодное) растворение.
Из очищенного раствора кобальт извлекается обычно либо химически в виде гидроокиси, либо электролитически в виде металла. В редких случаях электролитический способ применяется для получения гидроокиси кобальта.
Анодное получение кобальта
Электролитическое растворение применяется для перевода в раствор кобальта из металлических или сульфидных кобальтсодержащих сплавов. Основными компонентами таких сплавов, кроме кобальта, являются железо, никель и медь. Анодное растворение металлических сплавов производится в подогретом растворе серной кислоты. При этом на катоде основным процессом является выделение водорода. Кобальт, никель и железо из-за большой катодной поляризации в кислом растворе полностью остаются в электролите. Медь, растворившаяся на аноде, почти нацело осаждается на катоде, поэтому растворы, полученные анодным растворением, практически не содержат меди, что облегчает последующую их переработку. По мере электролиза раствор становится все менее кислым. Процесс прекращают, когда достигается почти полная нейтрализация электролита.
В качестве примера анодного растворения металлического кобальтсодержащего сплава можно привести переработку кобальта железных анодов, получаемых восстановительной электроплавкой конверторных шлаков на Норильском комбинате. Сплав содержит 6—7% Со, около 60% Fe, 30% Ni и 6% Сu. Исходный раствор электролиза содержит около 100 г/л H2SO4; анодное растворение ведут до содержания 20—30 г\л H2SO4, при этом в раствор переходят 7—8 г/л Со, 50—70 г/л Fe, около 30 г/л Ni и 0,2—0,6 г/л Сu. Этот процесс происходит при плотности тока до 400 а/ж2; напряжение на ванне составляет 3—3,5 в; выход анодного скрапа равен примерно 20%.
Процесс электролитического растворения осложняется, когда сплав содержит большое количество серы. В этом случае в кислом растворе происходит выделение ядовитого сероводорода. Чтобы избежать этого, электролиз сульфидных сплавов и металлических сплавов, содержащих значительное количество сульфидов, ведут 8 растворе хлорида натрия. При этом сера из анода переходи в шлам, а все растворяющиеся анодно металлы сразу же связываются в труднорастворимые гидроокиси (зеленые гидраты). Зеленые гидраты отфильтровывают и затем растворяют в серной кислоте. В этом процессе очистки от меди не происходит.
Электролитическое получение металлического кобальта
Электролитическое получение металлического кобальта применяется как для непосредственного выделения кобальта из раствора (электроэкстракция), так и для электролитического рафинирования загрязненного кобальта, полученного огневыми способами.
В металлургии кобальта электроэкстракция имеет большое значение, электролитическое рафинирование огневого кобальта применяется реже.
Как уже отмечалось, катодное выделение кобальта сопровождается значительной поляризацией, причем последняя проявляется сильнее в сульфатных растворах, чем в хлоридных. Большая величина поляризации делает возможным совместное выделение на катоде кобальта и водорода и таких электроотрицательных примесей, как железо. Для снижения скорости выделения водорода электролиз следует вести из возможно менее кислых растворов.
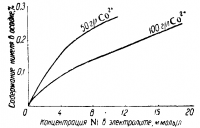
Для получения чистого катодного кобальта электролит должен быть очищен не только от таких электроположительных примесей как медь и свинец, но и от никеля и железа. Никель, обладающий почти равным с кобальтом равновесным потенциалом, из-за своей большей поляризации осаждается на катоде медленнее кобальта. Поэтому отношение Со: Ni в катодном осадке ниже, чем в электролите, причем эта разница возрастает с повышением концентрации кобальта в растворе (рис. 2).
Для получения высокочистого кобальта требуется весьма полная очистка раствора от никеля. Железо, имеющее значительно более электроотрицательный стандартный потенциал, чем кобальт, и обладающее также значительной катодной поляризацией в меньшей степени загрязняет ос а дай чем никель (особенно при высоких температурах), тем не менее и от него требуется тщательная очистка. Наиболее сложна очистив от никеля. В практике применяют различные способы: осаждение никеля диметилглиоксимом, гидролитическую очистку и др. Первый способу основан на образований нерастворимого соединения — диметилглиоксимата никеля:
2(CH3)2C2(NOH)2 + Ni2+ → [(CH3)2CNOHCNO]2Ni + 2Н+
Этот способ требует тщательного соблюдения режима осаждения и связан с большим расходом дорогого диметилглиоксима.
Гидролитическая очистка состоит в окислении Со2+ до Со3+ хлором или гипохлоритом натрия и осаждении из раствора гидроокиси кобальта.
Проведя несколько раз процесс осаждения и растворения гидроокиси кобальта, можно добиться весьма совершенного разделения кобальта и никеля.
Очистку от железа производят также путем окисления его и осаждения из раствора, однако, обычно в качестве окислителя используется воздух, а нейтрализацию раствора производят содой, молотым известняком или карбонатом кобальта.
При осаждении требуется строгое регулирование рН (около 3,9 для солянокислого и 4,4 для сернокислого растворов), чтобы не допустить осаждения основного карбоната кобальта. При осаждении железа с помощью карбонатов в осадок выпадает также значительная часть меди и свинца.
Полную очистку электролита от меди и свинца можно осуществить осаждением их в виде сульфидов. Осаждение производят с помощью сероводорода или сульфида натрия в слабокислом растворе (рН=1—4):
CuSО4 + H2S→ CuS + H2SО4 CuSО4 + Na2S → CuS + Na2SО4
Сульфидная очистка применяется и для удаления из электролита цинка. С помощью бисульфида (кислого сульфида) натрия кобальтовые растворы могут быть очищены также и от никеля.
В ряде случаев грубая очистка от меди производится электрохимически, путем электроэкстракции меди из кобальтового раствора при сравнительно небольшой плотности тока (порядка 150 а/м2) в кислом электролите. При этом на катоде из металлов осаждается только медь (в виде губчатого осадка).
В последнее время для очистки кобальтового электролита предложили экстракцию примесей жирными кислотами. Способ этот основан на протекании обменных реакций между металлами, находящимися в разных фазах: в органической — в виде солей жирных кислот (мыл) и в водной — в виде сульфатов и хлоридов. Для экстракции используют фракции С7—C9 или С11—С13 (число атомов углерода в молекуле кислоты) монокарбоновых кислот алифатического ряда общей формулой CnH2n+1COOH.
По способности переходить в органическую фазу ионы металлов располагаются в следующий ряд: Sn4+, Bi3+, Fe3+, Pb2+, Al3+, Cu2+, Cd2+, Zn2+, Ni2+, Co2+, Mn2+, Mg2+ Na+. В этом ряду каждый
Левее находящийся металл вытесняет все правее стоящие металлы из органической фазы. Таким образом, путем проведения обменной реакции все примеси, стоящие в ряду левее кобальта, могут быть удалены из кобальтового электролита.
Для очистки кобальтового раствора его обрабатывают кобальтовой солью жирных кислот (кобальтовым мылом); при этом имеет место обменная реакция типа:
3CoR2+2FeCl3 → 3CoCl2 + 2FeR3
где R — кислотный остаток жирной кислоты CnH2n + 1COO.
Экстракция жирными кислотами позволяет получить весьма высокую степень очистки электролита практически от всех примесей, мешающих электролизу кобальта.
Процесс электроэкстракции кобальта в крупном промышленном масштабе применяется на зарубежных заводах. Электролиз ведут в прямоугольных ваннах без диафрагм, футерованных кислотоупорным материалом (спецасфальт, свинец). Аноды отливаются из сплава свинца с сурьмой (6: 1), катодные основы делаются стальными.
Для поддержания высокого рН электролита с целью предотвращения выделения на катоде водорода в ванну добавляется гидрат закиси кобальта и рН раствора удерживается на уровне 6,0—6,3. Содержание кобальта в электролите (в виде CoSO4) составляет 15—30 г/л.
Практикуется работа на плотностях тока 180—500 а/м2. При плотности тока 180 а/м2 (содержание кобальта в электролите 30 г/л) катодный осадок получается достаточно ровным, напряжение на ванне составляет около 3 в, катодный выход по току около 80%, время наращивания катодов равно 5 суткам.
Температура электролита составляет 50—60° С. Для перемешивания раствора в ванне в нее по трубкам подают сжатый воздух.
В зависимости от глубины очистки электролита содержание кобальта в катодном осадке колеблется от 93,0 до 99,9 %.
У нас электроэкстракция кобальта применяется для получения металла высокой чистоты — значительно более чистого, чем огневой кобальт. Очистку кобальтового электролита от примесей ведут сейчас экстракцией жирными кислотами фракции С7—С9. При этом получают раствор, содержащий не свыше 0,01 г/л Ni, 0,001 г/л Fe, 0,0005 г/лСu. Содержание кобальта в электролите 130 г/л.
Электроэкстракцию ведут в ваннах с диафрагмами. Поэтому в нейтрализации выделяющейся кислоты в ванне нет надобности, и гидрат закиси кобальта в электролизер не подают. Это позволяет получать более качественные катодные осадки.
Электролиз ведут в футерованных винипластом ваннах с графитовыми анодами и титановыми катодными основами, диафрагмы — полихлорвиниловые. Катодная плотность тока составляет 300—350 а/м2, напряжение на ванне равно около 3 в, удельный расход электроэнергии порядка 4000 кет • ч/т, Температура электролита 60° С. Электролитный кобальт содержит не менее 99,99% Со.
Электролитическое рафинирование огневого кобальта нашло применение на некоторых зарубежных заводах. Электролиз ведут в ваннах с диафрагмами, так же, как и электролитическое рафинирование никеля. Электролит — сульфат-хлоридный, содержит:
60 г/л Со2+, 40 г/л Na+, 170 г/л SO2-4«, 10 г/л Cl— и 10 г/л Н3ВО3. Температура 60° С; рН = 3,3.
Катодными основами служат листы из нержавеющей стали. Осадок наращивают в течение 7 суток при плотности тока около 160 а/м2. Очистка электролита (от никеля и меди — сульфидом натрия, от железа — гидролитическая) обеспечивает получение электролитного кобальта с содержанием 99,5—99,6%.
Электролитическое получение гидроокиси кобальта
Один из основных продуктов кобальтового производства — гидроокись кобальта— получают обычно осаждением кобальта после его окисления хлором или гипохлоритом из раствора, очищенного от железа (никель после осаждение кобальта остается в растворе). В некоторых случаях осаждение гидроокиси кобальта ведут электролитически анодным окислением кобальта. В принципе этот метод существенно не отличается от обычного химического.
В очищенный от меди и железа раствор, содержащий кобальт, добавляют хлорид натрия и ведут электролиз в ванне с графитовым анодом и медным катодом. Процесс проводят при повышенной плотности тока; электролит нейтрализуют раствором соды. На аноде происходит выделение хлора, который окисляет кобальт; последний осаждается в виде гидроокиси и извлекается из ванны. Способ этот не получил широкого распространения.
Статья на тему Получение кобальта


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.