Что такое получение кадмия
Кадмий относится к числу относительно редких цветных металлов. В основном его используют в производстве щелочных (кадмиево-никелевых) аккумуляторов, для антикоррозийных покрытий (кадмирование) и для приготовления специальных припоев. Мировое производство кадмия составляет сейчас около 10 тыс. т в год.
В природе кадмий встречается в качестве примеси к рудам других цветных металлов. Основным сырьем для его производства служат побочные продукты, получаемые в металлургии цинка и свинца. Извлечение кадмия из этого сырья может производиться либо пирометаллургическим (дробная дистилляция), либо гидрометаллургическим методом, либо комбинацией того и другого. Наиболее распространенным является гидрометаллургический метод. Получение кадмия по этому способу проводят следующие операции: 1) окисление кадмия, 2) выщелачивание, 3) очистку раствора и осаждение кадмиевой губки, 4) окисление губки, повторное растворение ее и очистку раствора, 5) электроэкстракцию, 6) переплавку катодного кадмия.
Окисление кадмия производят в тех случаях, когда кадмий в сырье находится в основном в виде металла, и сырье, кроме того, содержит мышьяк, сурьму и германий. Цель окисления — перевести металлический кадмий в более легко растворимую окись и удалить большую часть мышьяка, сурьмы и германия. Окисление производится обжигом материала при 600 — 700°С, мышьяк, сурьма и германий улетучиваются при этом в виде окислов.
Выщелачивание огарка или сырого материала производится частью отработанного электролита кадмиевых или цинковых электролитных ванн, содержащего соответственно 50—80 или 90—120 г/л свободной H2SО4. Кадмий переходит в раствор в виде сульфата CdSО4; вместе с ним растворяется некоторое количество меди, цинк, часть железа и другие примеси (As, Sb, Со и др.). Полученный раствор содержит, например, 5—7 г/л Cd, 90—100 г/л Zn, 15—20 г/л Сu, 0,03—0,09 г/л Fe и небольшое количество других примесей.
Раствор подвергают очистке от меди цементацией. Цементацию производят с помощью цинковых листов и цинковой пыли. Содержание меди в растворе в процессе очистки снижают до 0,1—0,2 г/л (более полной очистки производить нельзя, так как начинает цементироваться кадмий). Помимо очистки от меди, раствор в ряде случаев очищают от железа, мышьяка и сурьмы (гидролизом), от свинца (соосаждением с сульфатом стронция). Очищенный раствор направляют на цементацию кадмия. Цементацию производят с помощью цинковой пыли, подающейся в избытке. Цементный кадмий (кадмиевая губка) содержит приблизительно 50% Cd, 20% Zn, 3% Сu. Содержание кадмия в растворе снижается до 0,01 г/л.. Этот раствор направляют на электролиз цинка. Полученную кадмиевую губку в металлическом виде или после предварительного окисления направляют на растворение. Для окисления губки ее складывают в штабеля. В процессе хранения в теплом и влажном помещении в течение 2—3 недель кадмий окисляется до CdO.
Электроэкстракция кадмия имеет много общего с электроэкстракцией цинка, хотя кадмий значительно более электроположительный металл (стандартный потенциал φ° Cd/Cd2+ = — 0,4в).
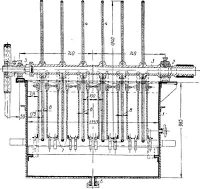
Рис. 2. Ванна с вращающимися катодами для электролиза кадмия:
1—корпус; 2— вал с катодами; 3— втулка; 4 — катод; 5—зажимная гайка; 6 — сливной патрубок; 7 — аноды.
Основным катодным процессом является реакция:
Cd2++2e → Cd
На аноде идет окисление молекул воды:
Н2О — 2е → 2Н++0,5О2
Суммарная реакция процесса
CdSО4 + Н2О → Cd + H2SО4 + 0,5О2
приводит к регенерации серной кислоты.
Значительное перенапряжение водорода на кадмии делает возможным осаждение металла в кислом растворе с приемлемым выходом по току. Отработанный электролит содержит 50—80 г/л свободной H2SО4 и 25—100 г/л Cd.
Основной примесью в электролите является цинк. Благодаря значительно более электроотрицательному стандартному потенциалу (φ° Zn/Zn2+ = — 0,76 в), его выделение на катоде возможно лишь при очень высоком содержании в растворе или при большой катодной поляризации. При содержании в отработанном электролите 30—35 г/л Cd концентрация Zn2+ в растворе допускается до 60 г/л для плотности тока 35—50• а/м2. При меньшем содержании цинка электролит можно обеднять кадмием в более высокой степени (до 10 г/л), плотность тока в этом случае может быть большей.
Катодное осаждение кадмия, происходит со значительным образованием дендритов, поэтому в электролит приходится добавлять поверхностно-активные вещества (столярный клей). По этой же причине при электроэкстракции кадмия применяют в ряде случаев ванны с вращающимися электродами.
Если отработанный электролит кадмиевого электролиза содержит относительно небольшое количество цинка, его направляют в основном на выщелачивание кадмиевой губки. Электролит, обогащенный цинком, либо идет на выщелачивание исходного сырья (кеков), либо поступает на регенерацию (осаждение кадмиевой губки). Обусловленный этим дефицит кислого раствора в схеме выщелачивания губки компенсируется введением серной кислоты.
Электролиз кадмия осуществляют в ваннах обычного типа и в ваннах с вращающимися катодами.
Первые ничем принципиально не отличаются от цинково электролитных ванн. В отличие от электролиза цинка, где электролит приходится охлаждать, здесь электролит иногда требует подогрева. Для подогрева в ванну помещают свинцовый змеевик.
Ванна с вращающимися катодами (рис. 2) представляет собой металлический или деревянный чан, футерованный твердой резиной или свинцом. Над ванной укреплен вал с закрепленными на нем дисками-катодами. Диски изготовляют из алюминия. По окружности они окантованы резиновым кольцом. Катоды зажимаются на валу с помощью расположенных между ними гуммированных втулок и гайки, находящейся на одном из концов вала. Аноды представляют собой сегменты, расположенные по обе стороны от погруженной в электролит части катодного диска. Их отливают из сплава свинца с серебром и перфорируют. Анодов в ванне вдвое больше, чем катодов.
Скорость вращения вала составляет до 15 об/мин (линейная скорость окружности диска при этом равна примерно 1,25 м/сек). Большая скорость приводит к разбрызгиванию электролита. Выход по току при электроэкстракции кадмия составляет от 80 до 95%.
Плотность тока колеблется в пределах 45—150 а/м2, в ваннах с вращающимися катодами она доходит до 300 а/м2. Напряжение на обычных ваннах 2,5—2,6 в, на ваннах с вращающимися катодами доходит до 4 в. Температура электролита 30—40° С. Расход коллоидных добавок (столярного клея) составляет примерно 4—4,5 кг на 1 т кадмия. Удельный расход электроэнергии колеблется в пределах 1300—2000 кет•ч/т. Электролитный кадмий содержит примерно 99,95% Cd.
Слой кадмия с катодов снимают периодически. О. А. Хан с сотрудниками разработал способ непрерывного получения на вращающемся катоде кадмия в виде порошка. Осадок с вращающегося катода снимают ножом и удаляют из ванны без ее остановки.
Статья на тему Получение кадмия


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.