Теория:
Степень окисления бериллия (Be) — это условный заряд атома в соединении, рассчитанный из предположения, что все ковалентные полярные связи имеют ионный характер.
Поэтому для него характерны две степени окисления:
- 0 — в свободном (элементарном) состоянии.
- +2 — в соединениях (единственная устойчивая степень окисления).
Степень окисления +1 для бериллия не существует в обычных условиях, потому, что это (экстремальные лабораторные эксперименты, нестабильные газофазные частицы).
Относится к щелочноземельным металлам, которые находятся во 2-м периоде периодической таблицы (в старой форме таблицы – IIА -группа).
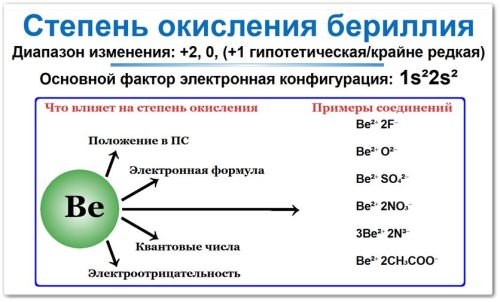
Причина единственной степени окисления (+2) заключается в его электронной конфигурации: 1s2 2s2 (два легко отдаваемых электрона на внешнем уровне, после потери которых атом достигает стабильности Гелия).
Как определить степень окисления бериллия
Степень окисления бериллия определяется его местом в Периодической системе, электронной структурой, электроотрицательностью, химическим поведением в соединениях.
Положение в Периодической системе
- Бериллий (Be) находится во 2‑й группе (главная подгруппа), 2‑й период. Для элементов главных подгрупп:
- Высшая (максимальная) степень окисления обычно равна номеру группы, для него это +2.
Электронная конфигурация
Основная конфигурация: 1s22s2 (2 электрона на внешнем уровне).
Чтобы достичь устойчивой конфигурации благородного газа (He), бериллий отдаёт оба валентных электрона → образуется ион Be2+.
Это и даёт степень окисления +2.
Электроотрицательность
- Значение по Полингу: 1,57 (относительно низкое).
- В соединениях с более электроотрицательными элементами (O, F, Cl и др.) бериллий выступает как восстановитель — отдаёт электроны → СО = +2.
Типичные соединения (проверка на практике)
- BeO (оксид бериллия): Be — +2, O — −2.
- BeCl2 (хлорид бериллия): Be — +2, Cl — −1.
- Be(OH)2 (гидроксид бериллия): Be — +2, OH — −1.
Во всех устойчивых соединениях бериллий имеет СО = +2.
Исключения и нюансы
- В свободном состоянии (металлический Be) степень окисления = 0.
- В некоторых экзотических/нестабильных системах теоретически возможна СО = +1, но это нехарактерно и не встречается в обычных условиях.
Квантовые числа
- Для первого 2s‑электрона: n = 2, l = 0, mₗ = 0, mₛ = +½.
- Для второго 2s‑электрона: n = 2, l = 0, mₗ = 0, mₛ = −½.
Почему степень окисления бериллия +2, +1 и 0
Степень окисления бериллия (Be) может принимать значения +2, +1 и 0, но эти значения отражают совершенно разную химическую стабильность и состояние атома.
+2 (Высшая и Единственно Стабильная)
Степень окисления +2 является основной и характерной для бериллия в химических соединениях.
Электронная конфигурация: Be имеет 1s2 2s2. У него два внешних электрона (2s2).
Стабильность: Отдав оба этих электрона, Be образует ион Be2+ с крайне стабильной, завершённой оболочкой Гелия (1s2).
Энергетика: Первая и вторая энергии ионизации достаточно низкие, чтобы легко оторвать оба 2s-электрона.
Третья энергия ионизации резко высока, что препятствует потере третьего электрона. Это энергетически фиксирует СО на +2.
+1 (Крайне Нестабильная)
Степень окисления +1 (соответствует иону Be+) — редкое и неустойчивое состояние.
Это состояние возникает, когда атом Be теряет только один 2s-электрон (Be⁺ имеет конфигурацию 1s2 2s1).
Нестабильность: Ион Be+ всё ещё имеет один неспаренный электрон на внешней орбитали, который он стремится немедленно отдать, чтобы перейти в стабильное состояние Be2+.
СО = +1 встречается только как короткоживущий промежуточный ион в условиях высокого разрежения (например, в газовой фазе) и не наблюдается в устойчивых соединениях.
0 (Низшая)
Степень окисления 0 соответствует свободному атому или металлическому бериллию (Be).
В этом состоянии атом не участвует в химических связях, и его заряд (условная степень окисления) равен нулю.
Это низшая степень окисления для бериллия.
Примеры соединений бериллия всех степеней окисления
Для бериллия реально устойчивая и практически единственная степень окисления — +2. Степень окисления 0 присуща элементарному (свободному) бериллию.
Степени окисления +1 и иные значения не характерны для обычных химических соединений и встречаются лишь в исключительных, высокоспецифических условиях.
Соединения бериллия со степенью окисления +2 (основные и типичные)
Это подавляющее большинство известных соединений бериллия:
Оксид BeO — белое тугоплавкое вещество с высокой теплопроводностью; амфотерный.
Гидроксид Be(OH)2 — амфотерный гидроксид (реагирует и с кислотами, и со щелочами).
Фторид BeF2 — соль с полимерной структурой в твёрдом состоянии.
Сульфат BeSO4 — растворяется в воде, даёт кислые растворы из‑за гидролиза.
Нитрат Be(NО3)2 — также образует кислые водные растворы.
Карбонат BeCO3 — разлагается при нагревании.
Нитрид Bе3N2 — соединение с высокой температурой плавления, гидролизуется водой.
Фосфат Be3(PO4)2 — малорастворим.
Соединения со степенью окисления 0
Элементарный бериллий (металлический Be) — в этом состоянии степень окисления равна 0.
Крайне редкие/специфические случаи (степень окисления +1)
В научной литературе описаны единичные комплексы со связью Be–Be, формально соответствующие степени окисления +1,
Пример решения, задача:
▶️ Дано:
Соединение — BeCl2 (хлорид бериллия).
⌕ Найти:
Определить степень окисления бериллия (СО) в соединении.
✨ Решение:
Известно, что степень окисления хлора (Cl) в хлоридах всегда равна −1.
В молекуле BeCl2 — два атома хлора, значит, их суммарный заряд:
2 × (−1) = −2.
По правилу электронейтральности сумма степеней окисления всех атомов в соединении равна нулю. Обозначим степень окисления бериллия за x:
x + (−2) = 0.
Решаем уравнение:
x = +2.
✅ Ответ:
Степень окисления бериллия в его соединении BeCl2 (хлорид бериллия) равна +2.
Часто задаваемые вопросы:
В подавляющем большинстве соединений бериллий проявляет степень окисления +2.
Степень окисления +1 для бериллия крайне редка и нестабильна.
Встречается в газовой фазе при высоких температурах, в некоторых металлоорганических соединениях или кластерных структурах, в плазме.
Нет, отрицательные степени окисления для бериллия не характерны и практически не встречаются.
Отрицательные степени окисления для Be невозможны в рамках обычной химии.