Фосфат магния это сложное неорганическое вещество в состав которого входит: магний, фосфор Р и кислород О2.
Химическая формула фосфата магния Mg3(PO4)2, основное применение в пищевой промышленности и получении веществ в состав которых входит фосфор и магний.

Что такое фосфат магния
Фосфат магния представляет собой обычную соль магния и фосфата, которые образуются в различных гидратах, таких как мономагнийфосфат, димагнийфосфат и тримагнийфосфат.
Молярная масса 262,855 г/моль. Температура плавления 1357 °C. Растворимость в воде 3,9 · 10–26 г/100 мл.
Фосфат магния представляет собой неорганическое соединение, которое образуется в результате электростатической связи между электроположительным катионом магния и электроотрицательным анионом фосфата и, таким образом, природа связи фосфата магния является чисто ионной.
Установлено, что он аморфен по своей природе и, поскольку образует различные гидраты солей магниевой кислоты и фосфорной кислоты, следовательно, их значения для кристаллизации воды различаются.
Химическая формула фосфата магния равна Mg3(PO4)2.
Ионная химическая формула фосфата магния представлена в виде Mg2+[PO4]3-.
Структура фосфата магния
Согласно химической формуле фосфата магния, которая составляет Mg3(PO4)2, двухвалентный ион магния находится в ионной связи благодаря электростатической силе притяжения с трехвалентным электроотрицательным фосфат-ионом.
И полученная структура представляет собой электровалентную структуру фосфата магния.
Структурно-молекулярная формула фосфата магния проиллюстрирована ниже.
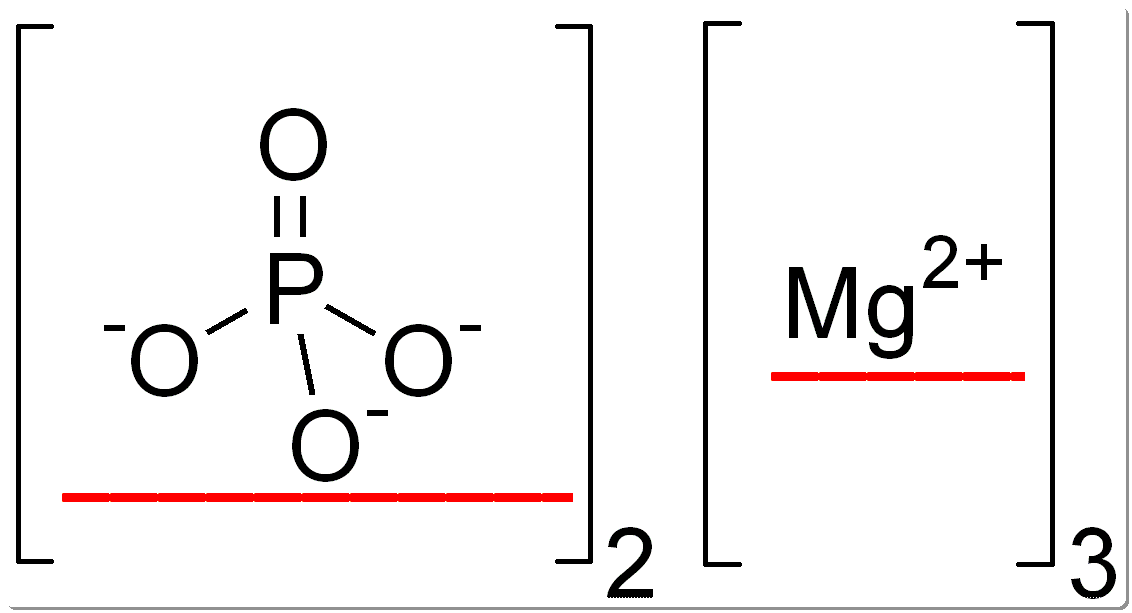
В молекулярной формуле фосфата магния магний является единственным металлом, тогда как сера и кислород являются неметаллами.
Таким образом, атомы кислорода и серы ковалентно связываются вместе, образуя трехвалентные электроотрицательные атомы сульфата.
А два ковалентно связанных электроположительных атома магния образуют ионную связь с тремя атомами сульфата, которые электростатически притягиваются друг к другу.
Мономагнийфосфат (H4MgO8P2)
Это белое кристаллическое вещество без запаха с молекулярной массой 218,277 г / моль.
В основном оно находится в порошкообразной форме и растворимо в воде, поэтому используется в качестве добавки.
Эта формула магния и фосфата также известна как формула дигидрофосфата магния.
По сути, это кислая магниевая соль дифосфорной кислоты, которую синтезируют путем медленного добавления водной дисперсии гидроксида натрия к фосфорной кислоте до тех пор, пока молярное соотношение фосфора и магния не станет равным 1:2.
Вся эта реакция проводится при 60 ºС и около 0,1% перекиси водорода добавляют к реакционной смеси, которую затем в конечном итоге высушивают и измельчают.
Он находит функциональное применение в качестве подкислителя, стабилизатора и разрыхлителя.
Димагнийфосфат (HMgO4P)
Это белое кристаллическое вещество в порошкообразной форме с молярной массой, равной 120,283 г/моль.
Его плотность в виде тригидрата составляет 2,13 г/см3. Он также известен как формула гидрофосфата магния.
Это магниевая соль фосфорной кислоты, в которой магний и фосфор присутствуют в молярном соотношении 1: 1 и являются двухосновными по своей природе.
Не имеет запаха, плохо растворим в воде, но хорошо растворим в разбавленных кислотах и нерастворим в этаноле.
Это очень хорошая пищевая добавка, которая широко используется во многих детских смесях, а также в добавках для спортсменов. Он считается питательным дополнением, а также питательным агентом.
Тримагнийфосфат (Mg3O8P2)
Это магниевая кислотная соль фосфорной кислоты белого кристаллического цвета с переменным количеством кристаллизационной воды, где X = 0,5,8,22.
Он имеет молярную массу, равную 262,855 г/моль, и абсолютно нерастворим в воде, но растворим в солевом растворе. Его температура плавления составляет 1184 ºC
Это октагидрат, который в природе встречается в бобьеррите в виде минерала. Магний и фосфат этой кислой соли магния находятся в молярном соотношении 2:3.
Октагидратная форма соли магния [Mg(PO4)2]・8H2O образуется, когда мономагнийфосфат в его стехиометрическом количестве вступает в реакцию с гидроксидом магния.
Безводная форма соли получается при нагревании октагидрата при 400 ºC.
Получение
В лабораторных условиях фосфат магния получают с помощью фосфорной кислоты и магния:
Mg + 2H3PO4 → Mg3(PO4)2 +3H2↑
А также может быть получен из оксида магния и фосфорной кислоты:
3MgO + 2H3PO4 → Mg3(PO4)2 + 3H2O
Или путём нейтрализации, уравнение магния фосфата из гидроокиси:
3Mg(OH)2 + 3H3PO4 → Mg3(PO4)2 + 6H2O
Спеканием оксида магния и пирофосфата:
3Mg + Na4P2O7 (900 ºC) → Mg3(PO4)2 + 2Na2O
А также смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
3MgSO4 + 2Na2HPO4 + 2NaHCO3 → Mg3(PO4)2 + 3Na2SO4 + 2CO2 + 2H2O
Применение
1. Основное применение в продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
2. В аналитической химии.
3. В химии как химическое вещество в состав которого входит фосфор и магний.
4. Фосфат магния можно встретить в сыпучих моющих средствах. Он не позволяет порошку скомкиваться и поглощать излишки влаги, утрамбовываться, надолго сохраняет его чистящую способность.
Опасность для человека
Так как любые химические соединения можно всегда рассматривать как потенциально опасные для организма вещества.
Фосфат магния также несет в себе опасность связи с тем что может повышать давление человека при этом усиливая нагрузку на сердце и сосудистую систему.
Этому фактору в основном подвержены люди которые длительное время контактируют с ним.
Хотя соединение относится к 4 классу (малоопасные вещества). При работе с ними необходимо соблюдать технику безопасности и правила личной гигиены: работать в перчатках, после эксплуатации тщательно мыть руки и споласкивать рот, рекомендуется надевать маску или респиратор.
А помещение в котором работают должно тщательно проветриваться.
