Гидрометаллургия. Электролиз водных растворов
Электролиз проводят в электролитных ваннах призматической формы, где вертикально и параллельно друг другу поочередно подвешены пластинчатые металлические электроды — аноды и катоды. Все аноды соединены с положительным, а катоды с отрицательным полюсами источника постоянного электрического напряжения. Разность потенциалов между электродами можно представить как недостаток электронов на аноде и избыток их на катоде.
В растворе — электролите соли металлов диссоциированы на ионы, которые переносят ток, передвигаясь только под действием диффузии и перемешивания, а электродами они могут притягиваться или отталкиваться только в тонких приэлектродных слоях раствора.
Катод и анод названия условные, которые нельзя понимать как отрицательный и положительный полюсы ванны; хотя потенциал у первого всегда отрицательнее, чем у второго: оба электрода могут иметь положительные, отрицательные или разнозначные потенциалы относительно водородного электрода.
На катоде разряжаются не только катионы, но также анионы и нейтральные молекулы, способные восстанавливаться — в первую очередь наиболее сильные окислители. Окислительная способность при равных активностях (концентрациях) характеризуется величиной нормального окислительно-восстановительного потенциала, который называют также электродным или электрохимическим (табл.). Например, в кислом растворе, содержащем медь, железо (III) и ион нитрата, очередность катодного восстановления будет следующей:
NO—3 + 10Н+ + 8е = NH+4 + 3Н2О; Е° = 0,87 В,
Fe3+ = Fe2+; E° = 0,77 В,
Cu2+ + 2e = Cu; E° = 0,34B,
2H+ + 2e = H2; E°=± 0,00В.
В действительности, ион водорода гидратирован и его правильнее записать Н3O+; однако для упрощения мы это здесь и далее опускаем. Также упрощенно представлены и гидратированные ионы металлов.
На аноде окисляются анионы, катионы и нейтральные молекулы, способные отдавать электроны, сначала наиболее сильные восстановители:
Fe2+ — e = Fe3+; Е° = 0,77В; 2Н2О — 4е = О2 + 4Н+; Е° = 1,23 В.
Из щелочных растворов на аноде окисляются
ОН—4ОН— —4е = 2Н2О + О2; Е° = — 0,40 В.
Таблица Нормальные окислительно-восстановительные потенциалы и изобарные потенциалы образования ионов при 25° С
| п.п | Система | E°, В | Ион | Изобарный потенциал в водном растворе ΔZ0298. кДж |
| 1 | Ca—2е = Са2+ | —2,87 | Ca2+ | —553,9 |
| 2 | Mg — 2e = Mg2+ | —2,37 | Mg2+ | —457,4 |
| 3 | Al — 3e = Al3+ | —1,66 | Al3+ | —480,6 |
| 4 | Ti—2e = Ti2+ | —1,63 | Ti2+ | —314,6 |
| 5 | Zn — 2e = Zn2+ | —0,76 | Zn2+ | —146,7 |
| 6 | Fe — 2e = Fe2+ | —0,44 | Fe2+ | —79,1 |
| 7 | Cd — 2e = Cd2+ | -0,40 | Cd2+ | —77,2 |
| 8 | Co — 2e = Co2+ | —0,28 | Co2+ | —54,0 |
| 9 | Ni — 2e = Ni2+ | —0,23 | Ni2+ | —44,4 |
| 10 | Pb — 2e= Pb2+ | —0,13 | Pb2+ | —25,1 |
| 11 | Sn — 2e = Sn2+ | —0,14 | Sn2+ | —27,0 |
| 12 | H2 — 2e = 2H+ | 0,00 | H+ | 0,0 |
| 13 | Cu — 2e = Cu2+ | 0,34 | Cu2+ | 65,6 |
| 14 | Cu —e=Cu+ | 0,52 | Cu+ | 50,2 |
| 15 | Ag — e = Ag+ | 0,80 | Ag+ | 77,2 |
| 16 | 2H2O — 4e = O2 + 4H+ | 1,23 | H2O | —237,0 |
| 17 | 2Cl— — 2e = Cl2 | 1,36 | Cl— | — 131,8 |
| 18 | Au — 3e = Au3+ | 1,50 | Au3+ | 434,2 |
| 19 | Au — e = Au+ | 1,68 | Au+ | 162,1 |
| 20 | 2SO24— —2e = S2O28— | 2,05 | so42- | —741,0 |
Если в кислом растворе присутствуют хлориды, возможно
их окисление до хлора:
2Сl— — 2е = Сl2; E0 = 1,36 В.
Нормальные потенциалы соответствуют одномолярным активностям ионов, а при изменении концентраций они увеличиваются или уменьшаются, как это следует из уравнения Нернста:
Здесь: Е — искомый, а Е° — нормальный потенциал, В; R — газовая постоянная, равная 8,314 Дж/град;
Т — абсолютная температура, К; F — число Фарадея — 96500 Кл; п — число электронов;
К — отношение активностей, записанное подобно константе равновесия окислительно-восстановительной системы: в числителе произведение активностей окисленных продуктов, в знаменателе— восстановленных, те и другие в степенях стехиометрических коэффициентов.
Подставляя постоянные величины, в том числе модуль перехода к десятичным логарифмам и удобную для приближенных расчетов температуру 30° С (предлогарифмический коэффициент при этом — округленное число 0,06), получим расчетную формулу
Продолжая тот же пример, отметим возможность совместного разряда на катоде меди и водорода при следующем отношении активностей:
При αн+ =1 г-ион/л αСu =10-11 г-ион/л. Из этого видно, что даже при весьма малых концентрациях меди восстановление водорода на катоде термодинамически невозможно.
Всякий электролиз легко представить как химическую реакцию, протекающую под действием внешней разности потенциалов. Для этого надо соединить катодный и анодный процессы, например в кислом 1-м растворе:
на катоде 2Cu2+ + 4е = 2Cu; E0 = 0,34 В,
на аноде 2Н2O — 4е = 4H+ + О2; E0 = 1,23 В.
Суммарно 2Cu2+ + 2Н2O = 2Cu + 4Н+ + О2; E0=0,89В
Теоретически вычислить расход энергии можно двумя путями: из измене-Изобарного потенциала системы и по закону Фарадея. Применяя форму-(4) и используя табл. 4, найдем
ΔZ298 = 0 — 2•65,6 + 2•237 = 343 кДж
На 1 т меди потребуется
(343 : (2 • 63,53)) 106 = 2,7• 103 Мдж = 750 кВт•Ч.
То же получим исходя из затраты на 1 г-экв меди 96500 Кл (А•с), или 26,8 А•ч.
(26,8 : 31,77)106 • 0, 89 = 7,5•105 Втч = 750 кВт•ч.
Полученный результат значительно ниже фактической величины: в расчетах мы исходили из равновесного состояния и не учли падения напряжения в слое раствора между электродами и дополнительной разности потенциалов — поляризации, необходимой для проведения электролиза с технологически выгодной скоростью.
Практически напряжение на ванне будет:
V = Ea-EK + IRB.
Индексами а и к помечены потенциалы электродов, измеренные во время электролиза, они включают поляризацию; I — сила тока, R — сопротивление цепи ванны — электролита, электродов и мест их контакта с внешней цепью.
Выход по току — доля (или процент) тока, расходуемого на осаждение металла от общей его затраты, включающей совместное осаждение примесей и утечки через случайно возникающие побочные цепи. Кт всегда меньше единицы, или 100%. Практический расход энергии составит:
W= (It:Kт)υкВт•ч.
Статья на тему Гидрометаллургия, Электролиз водных растворов


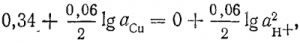

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.