ТЕРМОДИНАМИКА РЕАКЦИЙ АЛЮМИНИЯ
АпХт= пА + тХ.
Константа равновесия этой реакции, выраженная через активности компонентов, выражается уравнением:
Ка=anAamx/aAnxm
Она может быть подсчитана из величины изменения энергии Гиббса реакции:
ΔG°= — RTln Ка
По величине энергии Гиббса можно судить о возможности протекания реакции в ту или иную сторону. При больших отрицательных значениях ΔG° реакция полностью смещена вправо, при больших положительных — она самопроизвольно не происходит. В тех случаях, когда для участников реакции известны термодинамические данные, может быть подсчитано AG° реакции и определена величина константы равновесия.
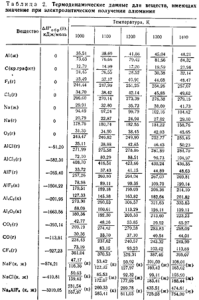
Таблица 2 . Термодинамические данные для веществ, имеющих значение при электролитическом получении алюминия
Если, например, известны следующие характеристики: стандартная энтальпия образования соединений, изменение энтальпии от стандартного состояния до определенной температуры и энтропия всех участников реакции, то изменение энтальпии и энергии Гиббса для реакции может быть подсчитано следующим образом. Изменение энтальпии — по величинам энтальпии компонентов реакции, причем для соединений принимается также энтальпия образования их из элементов в стандартном состоянии. Энтальпия реакции получается как алгебраическая сумма энтальпии всех компонентов, причем для продуктов реакции энтальпии принимаются со знаком плюс, для исходных веществ — со знаком минус. Изменение энергии Гиббса — из уравнения Гиббса—Гельмгольца ΔG°= ΔH°—TΔS°, где ΔS°— изменение энтропии участников реакции, Дж/(моль-К). Для подсчета ΔS°суммируются энтропии компонентов реакции, причем для исходных веществ принимаются отрицательные значения, для конечных — положительные.
В табл. 2 приведены термодинамические данные для веществ, имеющих значение при электролитическом получении алюминия, по справочнику В. П. Глушко «Термодинамические свойства индивидуальных веществ» (изд. «Наука» 1981 г.). Используя эти данные, Можно рассчитать термодинамические величины для основных реакций, протекающих в алюминиевых электролизерах.
Рассчитаем, например, величины ΔН° и ΔG° для реакции разложения глинозема на элементы при 1300 К:
Аl203(к) = 2Аl (ж) + 1,5 O2(г). (13)
Изменение энтальпии для алюминия 90,08 кДж, для кислорода 63,05 кДж, для глинозема —1537,45 кДж.
Изменение энтальпии для всей реакции ΔН = 1690,58 кДж.
Энтропия для алюминия: 163,92 Дж/(моль · К), для кислорода 379,16 Дж/(моль · К), для глинозема 213,60 Дж/ (моль · К). Общее изменение энтропии ΔS° = 329,48 Дж /(моль · К).
Изменение энергии Гиббса для реакции: ΔG° = ΔH° —TΔS°= 1262,26 кДж.
В расчете использованы данные для твердого глинозема. Эти данные могут быть использованы и для насыщенных растворов глинозема в электролите, поскольку химический потенциал глинозема в насыщенном растворе равен таковому для твердого глинозема. Состояние глинозема в насыщенном растворе будем принимать за стандартное, поэтому все величины для него имеют индекс ° (ΔН° и ΔG°).
Разложение глинозема
Анодные газы, выделяющиеся на промышленных электролизерах, содержат как СО, так и СO2. Эти компоненты газов образуются в результате протекания двух реакций разложения глинозема с участием углерода: Al2O3+ 3С = 2Аl + 3СО , (14)
Аl2O3 + 1,5С = 2Аl + 1.5СO2. (15)
Термодинамические расчеты для реакций дают величины ΔН°, ΔG° и напряжения разложения, приведенные ниже
Из этих данных следует, что изменение энтальпии реакции мало зависит от температуры, в то время как изменение энергии Гиббса и напряжение разложения заметно уменьшается с повышением температуры. Разность между ΔН° и ΔG° представляет собой связанную энергию (сумму теплот Пельтье для обоих электродов), которая для обеих реакций составляет значительную величину.
Для реакции (15) напряжение разложения как функция концентрации глинозема известно из экспериментальных данных (Ветюков и Нгуен Ван Бан) (рис. 14).
Рис. 14. Зависимость напряжения разложения глинозема от содержания Аl2O3 в системе Na3AlF6—А12O3 при 1000°С: 1, 3— для реакции (14); 2, 4— для реакции (15); /, 2 — в мольных долях Аl2O3, для 3, 4 — lgaAl2O3
Напряжение разложения глинозема с образованием СО может быть подсчитано с учетом известной величины (ΔG°) энергии Гиббса для реакции
1,5СO2+1,5С =3СО, (16)
равной при 1000°С —82,8 кДж на 1,5 моля СO2, итого, что реакция (14) представляет собой сумму реакций (15) и (16). Отсюда следует, что напряжение разложения при 1000 °С для реакции (15) будет на 0,135 В выше при любой концентрации глинозема, чем для реакции (14).
Поскольку между напряжением разложения Ep0 в стандартном состоянии и Ep при активности компонента а имеется соотношение:
то в координатах Ее— lga эта зависимость выражается прямой линией (см. рис. 14).
Так как анодные газы содержат и СO2, и СО, суммарная реакция в электролизе состоит из реакций разложения глинозема (14) и (15). Но от условий электролиза (температуры, состава электролита и др.) зависит, какая реакция превалирует. Поэтому число молей углерода, участвующих в суммарной реакции, будет переменным (обозначим его y). Тогда суммарную реакцию можно представить уравнением: Аl2O3+ уС = 2Аl + (3 — у) СO2 + (2у — 3) СО . (18)
Коэффициенты при СO2 и СО получены в результате совместного решения двух уравнений. Первое относится к распределению углерода между двумя реакциями 1,5к1+3к2=у, где K1 и к2—доли участия реакций (14) и (15) в суммарной реакции. Второе вытекает из условия K1 + K2 = 1.
Из этих уравнений следует: K1 = (6—2у)/3; к2 = (2у —3)/3. Энтальпия суммарной реакции ΔH° = k1ΔH1° + k2ΔH°2.
Остальные термодинамические величины для суммарной реакции могут быть рассчитаны аналогичным образом.
Разложение фторидов алюминия
Рассмотрим реакции разложения AF3 и NaF с учетом участия углерода и активности этих компонентов в расплаве. Для реакции
4AlF3+3C = 4Al + 3CF4 (19)
изменение энергии Гиббса при 1300 К составляет ΔG°1300k = 644 кДж/моль A1F3, что отвечает напряжению разложения фтористого алюминия Eр° = 2,22 В. Для состава криолита, где активность AlF3 равна 3 ∙ 10-4(см. рис. 8), напряжение разложения фтористого алюминия составит 2,52 В. Эта величина соответствует энергии Гиббса для реакции разложения криолита 2Na3AlF6 + 1,5С = 6NaF + 2 Al + 1,5CF4. (20)
Для реакции
4NaF + С = CF4+ 4Na (21)
изменение энергии Гиббса для чистого фторида натрия составляет при 1300 К 253 кДж/моль, что отвечает напряжению разложения Eр°=2,62 В. Для состава криолита напряжение разложения NaF повысится незначительно: Eр = 2,70 В.
Из вышеприведенных данных следует, что напряжение разложения фторида натрия на 0,34 В выше, чем фторида алюминия. Следовательно, потенциал выделения алюминия в стандартном состоянии на 0,34 В положительнее, чем натрия. Однако, как будет показано далее, это не исключает возможности совместного разряда алюминия и натрия.
Различие между напряжением разложения фторида алюминия по реакции (19) и глинозема по реакции (15) еще более значительно и составляет при 1300 К 1,07 В. Но и в данном случае не исключается возможность совместного разряда ионов кислорода и фтора при определенных условиях электролиза. При обычных же условиях электролиза на катоде происходит восстановление ионов алюминия, на аноде — окисление ионов кислорода, причем и те, и другие ионы находятся в расплаве в виде комплексов.
Основные электродные реакции
П. П. Федотьев, создавший теорию электролиза, считал, что первичным является разложение глинозема, причем электродные реакции сводятся к следующему. На катоде: Аl3++3е = Аl, на аноде: 2АlO33- — 6е = Аl2O3+1,5O2.
Выделяющийся кислород взаимодействует с углеродом анода, образуя смесь СO2 и СО.
Эта точка зрения Федотьева в основном принимается и в настоящее время, но с некоторыми коррективами, вытекающими из современных представлений о строении криолито-глиноземных расплавов.
Предположим, что взаимодействие глинозема с криолитом приводит к образованию простейшего типа ок-сифторидных ионов — AlOF2— и может быть представлено реакцией
Na3AlF6+ Аl2O3= 3NaAlOF2 =3Na+ +3AlOF2— .
Как мы уже видели, перенос тока осуществляется почти полностью ионами Na+; разряду подвергаются оксифторидные комплексные ионы.
Катодный процесс можно представить реакцией 3AlOF2— + 6е = 2Аl + 6F— + АlO33- . (22)
Анодный процесс: 3AlOF2— — 6е + 1,5С = 1,5СO2 + Аl3+ + 6F—. (23)
Рассмотрим, какие изменения произойдут в анолите и католите при прохождении 6 фарадеев электричества.
В католите в результате переноса тока накопилось 6 ионов Na+, кроме того от диссоциации 3NaAlOF2 осталось 3 иона Na+. Изменение состава католита сводится к накоплению 6 молей фторида натрия и 1 моля алюмината натрия: 9Na+ +6F— + AlO33- = 6NaF+Na3AlO3.
Из анолита в результате переноса ушло 6 ионов Na+ и осталось 6 ионов AlOF2—. Три из них разрядились по реакции (23), три остались в анолите. Вместе с избыточными ионами Аl3+ и F— получающимися при разряде, эти оксифторидные ионы дают 4 моля фторида алюминия и 1 моль глинозема: 3AlOF2— + 3Al3+ + 6F—=4AlF3 + А12O3.
Таким образом, в результате электролиза католит становится более «щелочным», а анолит — более «кислым». В условиях промышленного электролиза происходит энергичное перемешивание католита и анолита, и состав электролита почти выравнивается:
6NaF + Na3AlO3+ 4AlF3 + Аl2O3= 3Na3AlF6+2Al2O3. (24)
При пропускании 6 фарадеев электричества в процессе было вовлечено 9 молей NaAlOF2 (3 на катоде и 6 на аноде). Для образования такого количества оксифторидных комплексов понадобилось 3 моля глинозема. В результате всех процессов осталось 2 моля глинозема, один разложился при электролизе.
Взаимодействие алюминия с электролитом
Взаимодействие алюминия с электролитом приводит к растворению металла в солевом расплаве и переносу продуктов растворения к аноду, где они окисляются электрохимически на поверхности анода или химически анодными газами. В результате происходят бесполезные потери металла и выход по току на катоде становится меньше единицы. При производстве алюминия потери металла довольно значительны.
Вопрос о природе растворов металлов в расплавленных солях до сих пор остается дискуссионным. Наиболее приемлемыми считаются две гипотезы (Делимарский). Согласно первой из них, растворение металла в расплаве его соли сопровождается образованием нового химического соединения, в котором металл имеет пониженную степень окисления, так называемого субсоединения. Например, для металла Me и его галогенида МеХ2 получается субгалогенид: Ме + МеХ2 = 2МеХ,
В большинстве случаев считается что субгалогениды в расплавах полимеризованы (Сd2Cl2, Mg2Cl2 и т. д.).
Согласно второй гипотезе, металл, введенный в расплав его соли, частично ионизируется, причем электроны поступают в зону проводимости. Это вызывает частичную электронную проводимость образующейся ионно-электронной жидкости. Эта теория, по-видимому, более применима для растворов щелочных металлов в их расплавленных галогенидах.
При растворении алюминия в криолито-глиноземных расплавах происходят две реакции: взаимодействия алюминия с фторидом алюминия с образованием субфторида алюминия
Al + 1/2AlF3 = 3/2AlF. (25)
и обмена фторида натрия с алюминием
1/3Al + NaF = Na + 1/3AlF3 (26)
Течение этих реакций в значительной степени определяется активностью фторидов алюминия и натрия в расплаве, т. е. криолитовым отношением и температурой.
Образование субфторида алюминия связано с электронным строением атома алюминия. Во внешнем М-слое атома находится три электрона: два на 3s-орбите и один на 3р-орбите. Потенциал ионизации для первого Зр-электрона составляет 574,5 кДж/моль, для 3s1, электрона 1800 кДж/моль и для 3s2-электрона 2730 кДж/моль. Отсюда следует, что первый 3р-электрон отщепляется значительно легче последующих валентных электронов, что и приводит в определенных условиях к стабильности иона алюминия Аl+. При высоких температурах устойчивыми соединениями алюминия становятся субоксид Аl2O и субгалогениды, в том числе AlF.
Монофторид алюминия получается при взаимодействии фторида алюминия и алюминия при высоких температурах (начало заметного взаимодействия при 1000 °С). Давление пара AlF при 1027 °С—6265 Па, в то время как для фтористого алюминия 1932 Па. Реакция образования субфгорида алюминия протекает главным образом в кислых расплавах, при достаточно больших активностях фторида алюминия. При повышении температуры реакция сдвигается вправо, при понижении — происходит распад субфторида на мелкодисперсный алюминий и фторид алюминия.
Реакция обмена между алюминием и фторидом натрия (26) в основном протекает в области нейтральных и щелочных электролитов. Получающийся по этой реакции натрий не выделяется в виде самостоятельной фазы, а образует раствор натрия в электролите. При этом также образуется раствор натрия в алюминий. Растворимость натрия в алюминии невелика: при 1000 °С она оценивается величиной в 0,45% (по массе). Растворы натрия в электролите, по-видимому, являются ионно-электронными жидкостями, о чем свидетельствуют некоторые свойства этих растворов, рассмотренные ниже.
При закалке проб электролита, находившегося в равновесии с алюминием, в плаве находят дисперсные металлы — натрий, получившийся по реакции (26), и алюминий, образовавшийся в результате разложения субфторида алюминия. По результатам химико-аналитических определений алюминия и натрия в застывшем плаве можно судить о растворимости этих металлов в электролите.
Ниже приведена растворимость алюминия и натрия в электролите и натрия в алюминии при 1000 °С (Ветюков, Винокуров):
| При 1,5% (по массе) | |||||||
| Аl2O3 и К.О. | 1,6 | 1,8 | 2,0 | 2,5 | 3,0 | 3,2 | 3,6 |
| Растворимость, % (по массе): | |||||||
| Na в электролите | 0,056 | 0,058 | 0,064 | 0,074 | 0,093 | 0,116 | 0,140 |
| Аl в электролите | 0,138 | 0,130 | 0,102 | 0,077 | 0,063 | 0,051 | 0,043 |
| Na в Аl | — | 0,007 | — | 0,015 | 0,019 | 0,022 | 0,032 |
| При К.О. = 3 и Аl2O3% (по массе) | 1,5 | 3,5 | 5,5 | 7,5 | 10 | ||
| Растворимость, %(по массе): | |||||||
| Na в электролите | 0,093 | 0,090 | 0,087 | 0,080 | 0,065 | ||
| Аl в электролите | 0,063 | 0,068 | 0,064 | 0,055 | 0,058 | ||
Примечание. Прочерки означают, что растворимости в данных случаях не определяли.
С ростом криолитового отношения расплава концентрации натрия в электролите и в алюминии монотонно повышаются, что связано с увеличением активности NaF в расплаве (см. рис. 8), а концентрация алюминия в электролите понижается. Повышение концентрации глинозема при постоянном К.О. проявляется в уменьшении содержания натрия, в то же время как растворимость алюминия остается практически постоянной. Повышение температуры приводит к заметному сдвигу реакции (26) вправо: концентрация натрия в электролите при повышении температуры с 1000 до-1100°С увеличивается в 1,5 раза; концентрация растворенного алюминия при этих же условиях повышается всего на 15%.
Несмотря на сравнительно малые растворимости алюминия и натрия в электролите, сильная циркуляция расплава в промышленных ваннах приводит к быстрому переносу катодных продуктов в анодное пространство, где они окисляются, что приводит к значительным потерям металла.
Используя термодинамические данные для чистого газообразного монофторида алюминия, можно рассчитать. ΔG реакции (25), а для реакции образования натрия (26), термодинамические данные для всех участников этой реакции хорошо известны из литературных источников; результаты расчетов приведены в табл. 3. Здесь же указаны результаты экспериментального определения константы равновесия той или другой реакции. Как видно, экспериментальные и расчетные величины достаточно близки между собой.
Используя величины Ка и величины активности фторида натрия и фторида алюминия в системе NaF—AlF3 (см. рис. 8), можно вычислить активности натрия и субфторида алюминия в этой системе (рис. 15). Как
| Таблица 3. Термодинамические данные для реакций взаимодействия алюминия с электролитом | |||
| Метод определения | Т, к | ΔG °, кДж | Ka |
|
Реакция (25) |
|||
| Расчет (Костюков) Эксперимент (Ветюков, Винокуров) | 1300 1273 | 45,48 37,5 | 1,49 · 10— 2 2,84 · 10-2 |
|
Реакция (26) |
|||
| Расчет (Ветюков, Борисоглебский)
Эксперимент (Дюинг) |
1300 1293 | 53,25 52,15 | 7,25 · 10-3 7,8 · 10-3 |
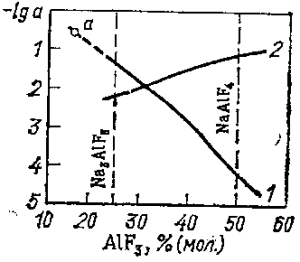
Рис. 15. Изотермы активности в системе NaF—AlF3—Al 1 —Na, 2 — AlF при 1020 °C (Дюинг). Точка a — давление пара натрия равно 101,325 кПа
Необходимо отметить, что активности натрия и AlF недостаточны для выделения их в виде пузырьков пара (т. е. в том случае, когда давление их пара будет равно атмосферному). Активность натрия равна единице для гипотетического жидкого металла. Давление насыщенного пара над металлом при 1020 °С составит 307,84 кПа. Давление пара в 100 кПа будет при активности натрия:
Но такой величины активность натрия достигает при 15% (мол.) AlF3 или при криолитовом отношении 5,6 (точка а на рис. 15); натрий при этом будет выделяться в виде пузырьков пара.
Взаимодействие анодных газов с электролитом алюминия
Растворение газов в расплавленных солях представляет большой интерес для технологии электролиза. Анодные газы являются сильными окислителями; переходя в электролит, они окисляют растворенный металл не только на границе электролит — газ, но и во всем объеме междуполюсного пространства.
Растворимость газов подчиняется закону Генри — с ростом давления газа над расплавом растворимость, увеличивается прямопропорционально:
Cs = kpp, (27)
где Cs — концентрация газа в расплаве, моль/см3; р — давление газа, Па; kp—растворимость газа, моль/(см3 · Па).
Если газ ведет себя как идеальный, что при высоких температурах и малых давлениях вполне соблюдается, давление его связано с концентрацией в газовой фазе Cq соотношением:
p = CqRT. (28)
Подставляя это значение р в выражение (27), получим:
Cs=kpRTCq= kcCq,
где kc— мольная доля газа в расплаве.
Зависимость растворимости от температуры подчиняется уравнению:
для концентрации газа в мольных долях:
kc=Ae-ΔH/RT , (30)
где ΔН — энтальпия растворения газа, кДж/моль; А — постоянная.
Энтальпию растворения можно рассматривать состоящей из двух слагаемых: одна обусловлена образованием в расплаве микрополостей, в которые входят молекулы газа (физическое растворение), другая — взаимодействием молекул газа с частицами расплава (химическое растворение). Первая, связанная с затратами энергии, положительна, вторая, связанная с выделением энергии, отрицательна. Если имеет место чисто физическое растворение, без заметного взаимодействия жидкости и газа, то с повышением температуры растворимость газа увеличивается. При химическом взаимодействии жидкости и газа растворимость с повышением температуры уменьшается.
На рис. 16 приведены некоторые данные о растворимости СО2 в расплаве NaCl и в криолито-глиноземных расплавах. Температурные зависимости для NaCl и
Na3AlF6—Al2O3 существенно различны: растворимость СO2 в NaCl с повышением температуры увеличивается, энтальпия растворения положительна и составляет 31 кДж/моль, т. е. имеет место физическое растворение. Для криалито-глиноземных расплавов растворимость на полпорядка выше и уменьшается с повышением температуры, энтальпия растворения отрицательна (—17 кДж/моль). Процесс растворения сводится к взаимодействию СO2 с оксифторидными комплексами расплава:
AlOF1-xx + CO2 = AlF3-xx + CO32-
Чем выше активность комплексов AlOF1-xx, тем больше растворимость СO2 в расплаве (рис. 16, б). Повышение температуры сопровождается распадом комплексов AlOF1-xx. и растворимость СO2 уменьшается.
Рис. 16. Растворимость СО2 в расплавах: а — температурная зависимость; 1— в расплаве NaCl; 2 — в криолито-гли-нозёмном расплаве (18,6% (моль.) Al2O3) ; б- концентрационная зависимость в системе Nа3АlF6—Аl2O3 при 1030 °С (Братланд, Гротгейм и др.)
Физико-химические свойства растворов газов в расплавленных слоях изучены недостаточно. Есть основания считать, что коэффициенты диффузии хлора, растворенного в расплавленных хлоридах, имеют величины на 1—2 порядка выше, чем для растворов солей друг в друге. Так же, как и для растворов металлов в их солях, здесь предполагается наличие наряду с обычным трансляционным движением механизма перескока электронов. Насколько это применимо к растворам анодных газов в электролите алюминиевых ванн, остается неясным.
Статья на тему Термодинамика реакций алюминия



Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.